题目内容
19.硫酸铜是一种重要的化工原料,工业上常以硫酸为原料来制备硫酸铜.(1)工业上生产硫酸的过程中,焙烧硫铁矿时产生的废渣是一种二次资源.
①为了从废渣中磁选获得品位合格的铁精矿,可在高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4.写出该反应的化学方程式:3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;实验发现,CO太多或太少都会导致磁铁矿产率降低,原因是CO太多导致Fe3O4还原为铁,CO太少,Fe2O3转化成Fe3O4的转化率不高.
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物.反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液.写出氯化焙烧工艺中生成HCl的化学方程式:CaCl2+SiO2+H2O$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+2HCl.
(2)测定硫酸铜晶体中结晶水含量的实验步骤如下,请补充完整.
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重;
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重;
步骤5:将步骤4中的坩埚再加热一定时间,放入干燥器中冷却至室温后,称重,重复本操作,直至两次称量质量差不超过0.1g;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶中的质量分数.
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物.现取25.0gCuSO4•5H2O晶体均匀受热,缓慢升温至1200℃并恒温1h,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如图所示:
在110℃时所得固体的成分为CuSO4•3H2O;升温至1200℃并恒温1h,反应所得气态产物除去水后,物质的量的取值范围是0.125mol<n(气体)<0.175mol.

分析 (1)①根据高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4,利用质量守恒确定产物并配平;CO太多导致Fe3O4还原为铁,CO太少,Fe2O3转化成Fe3O4的转化率不高;
②由题意可知:废渣中SiO2与CaCl2等在高温下反应放出HCl,所以水参加反应,所以化学方程式为CaCl2+SiO2+H2O$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+2HCl;
(2)根据直至两次称量质量差不超过0.1g确定完全失水;
(3)由图示数据可知,失去水的质量为:25.0g×14.4%=3.6g,根据关系式:CuSO4•5H2O~CuSO4•XH2O利用差量法求出X,从而得出化学式;1 000℃并恒温1小时左右,固体残留率为:28.8%,所以剩余固体的质量为:25g×28.8%=7.2g,根据Cu原子守恒可知Cu2O为0.05mol,所以固体反应产物只有Cu2O,反应方程式为:4CuO$\frac{\underline{\;1000℃~1200℃\;}}{\;}$ 2Cu2O+O2(g),则650℃~1000℃发生反应方程式为:CuSO4 $\frac{\underline{\;650℃~1000℃\;}}{\;}$CuO+SO3(g),而0.1mol硫酸铜晶体分解后得到0.1mol SO3和0.025mol O2,如0.1mol SO3完全分解将得到0.15mol的混合气体,然后计算.
解答 解:(1)①CO使弱磁性Fe2O3转化为强磁性Fe3O4和CO2,方程式为:3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;CO太多导致Fe3O4还原为铁,CO太少,Fe2O3转化成Fe3O4的转化率不高,所以CO太多或太少都会导致磁铁矿产率降低,
故答案为:3Fe2O3+CO$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2;CO太多导致Fe3O4还原为铁,CO太少,Fe2O3转化成Fe3O4的转化率不高;
②废渣中SiO2与CaCl2等在高温下反应放出HCl,所以水参加反应,所以化学方程式为:CaCl2+SiO2+H2O$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+2HCl,
故答案为:CaCl2+SiO2+H2O$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+2HCl;
(2)将步骤4中的坩埚再加热一定时间,放入干燥器中冷却至室温后,称重,重复本操作,直至两次称量质量差不超过0.1g,
故答案为:将步骤4中的坩埚再加热一定时间,放入干燥器中冷却至室温后,称重,重复本操作,直至两次称量质量差不超过0.1g;
(3)CuSO4•5H2O~CuSO4•XH2O△m
250 18(5-x)
25.0g 3.6g
则$\frac{250}{25g}=\frac{18(5-x)}{3.6g}$,
解得:X=3,所以在110℃时所得固体的成分为CuSO4•3H2O;
25.0g CuSO4•5H2O的物质的量为:$\frac{25.0g}{250g/mol}$=0.1mol,则 CuSO4的物质的量为0.1mol;
1 000℃并恒温1小时左右,固体残留率为:28.8%,所以剩余固体的质量为:25g×28.8%=7.2g,根据Cu原子守恒可知Cu2O为0.05mol,所以固体反应产物只有Cu2O,反应方程式为:4CuO$\frac{\underline{\;1000℃~1200℃\;}}{\;}$ 2Cu2O+O2(g)和2SO3$\frac{\underline{\;1000℃\;}}{\;}$2SO2+O2,则650℃~1000℃发生反应方程式为:CuSO4 $\frac{\underline{\;650℃~1000℃\;}}{\;}$CuO+SO3(g),而0.1mol硫酸铜晶体分解后得到0.1mol SO3和0.025mol O2,如0.1mol SO3完全分解将得到0.15mol的混合气体,气体的物质的量在0.125mol~0.175mol之间,
故答案为:CuSO4•3H2O; 0.125mol<n(气体)<0.175mol.
点评 本题主要考查了硫酸铜晶体中结晶水含量的测定、硫酸铜晶体分解产物的确定,注意差量法的使用和化学计算,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | ①② | B. | ②③ | C. | ②③④ | D. | ③④ |
| A. | 乙酸和乙醇 | B. | 花生油和Na2CO3溶液 | ||
| C. | 酒精和水 | D. | 溴和苯 |
 )+N2O4→N2↑+CO2↑+H2O(未配平).下列说法错误的是( )
)+N2O4→N2↑+CO2↑+H2O(未配平).下列说法错误的是( )| A. | C2H8N2分子中既含有极性键,也含有非极性键 | |
| B. | 火箭发射前要低温加注液态氧化剂N2O4,N2O4泄漏后可产生红棕色气体 | |
| C. | 氧化产物与还原产物的物质的量之比为2:3 | |
| D. | 该反应每消耗1mo N2O4时转移8 mol e- |
| A. | K+、Cu2+、Cl-、AlO2- | B. | Na+、Al3+、NO3-、HCO3- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Ca2+、Cl-、CO32-、NH4+ |
| A. | 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe和Fe2O3的物质的量一样多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |

 ,F
,F .
. .
. ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O. ,画出C元素的原子结构示意图
,画出C元素的原子结构示意图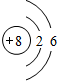 ;
;