题目内容
9.下列有关叙述:①非金属单质N能从M的化合物中置换出非金属单质M;②M原子比N原子容易得到电子;③Na-的还原性强于Mb-;④单质熔点M>N.能说明非金属元素M比N的非金属性强的是( )| A. | ①② | B. | ②③ | C. | ②③④ | D. | ③④ |
分析 元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强,其单质与氢气化合越容易,其简单阴离子的还原性越弱,据此判断非金属性强弱.
解答 解:元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强,其单质与氢气化合越容易,其简单阴离子的还原性越弱,
①非金属单质N能从M的化合物中置换出非金属单质M,说明N单质的氧化性大于M,则非金属性N>M,故错误;
②M原子比N原子容易得到电子,说明M的氧化性大于N,则非金属性M>N,故正确;
③Na-的还原性强于Mb-,说明非金属性M>N,故正确;
④非金属性强弱与单质的熔沸点高低无关,所以单质熔点M>N不能说明非金属性M>N,故错误;
故选B.
点评 本题考查非金属性强弱判断,明确非金属性强弱判断方法是解本题关键,注意非金属性强弱与得电子难易程度有关,与得电子多少无关,且非金属性强弱与单质的熔沸点无关,为易错点.

练习册系列答案
相关题目
18.1mL密度为0.93g•cm-3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气( )
| A. | 294.7L | B. | 378.0L | C. | 2240.0L | D. | 1120.0L |
15.已知A,B,C均为短周期元素,A,C同周期,A,C的最低价离子分别为Am-和Cn-,离子半径:Am-<Cn-,B2+和Cn-具有相同的电子层结构,下列说法正确的是( )
| A. | 原子序数:B>C>A | B. | 原子半径:B>A>C | ||
| C. | 对应气态氢化物的稳定性:A>C | D. | 还原性:Am->Cn- |
14.某烷烃的相对分子质量是72,其同分异构体的数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
1.已知酸性H2SO3>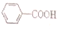 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )
 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
18.根据原子结构及元素周期规律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |


