题目内容
8.在由Fe、FeO和Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况下),此时溶液中无Fe3+离子.则下列判断正确的是( )| A. | 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe和Fe2O3的物质的量一样多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
分析 混合物恰好完全溶解,且无Fe3+,故溶液中溶质为FeCl2,n(HCl)=0.2mol,n(H2)=0.02mol,n(Fe2+)=0.1mol,由反应2Fe3++Fe═3Fe2+可知Fe比Fe2O3的物质的量多,但FeO的物质的量无法确定,据此对各选项进行判断.
解答 解:A.根据以上分析知Fe比Fe2O3的物质的量多,但FeO的物质的量无法确定,故无法确定混合物里三种物质反应时消耗盐酸的物质的量之比,故A错误;
B.反应后所得溶液为FeCl2溶液,阳离子与阴离子的物质的量之比为1:2,故B正确;
C.混合物恰好完全溶解,且无Fe3+,故溶液中溶质为FeCl2,由铁与酸反应生成氢气及反应2Fe3++Fe═3Fe2+知Fe比Fe2O3的物质的量多,故C错误;
D.FeO的物质的量无法确定,不能确定Fe与FeO的物质的量的关系,故D错误;
故选B.
点评 本题考查混合物的计算,题目难度中等,解答时注意反应的现象,根据恰好使混合物完全溶解并放出448mL气体(标准状况),此时溶液中无Fe3+离子进行判断.

练习册系列答案
相关题目
18.根据原子结构及元素周期规律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |
16.下列有机物中能发生消去反应,且生成物中存在同分异构体的是( )
| A. | 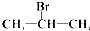 | B. |  | C. |  | D. | CH3Cl |
3.下列实验现象和对应的结论描述都正确的是( )
| A. | 往某固体中滴加稀盐酸有气泡产生--该固体一定是碳酸盐 | |
| B. | 往某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀--该溶液一定含有硫酸根离子 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 往品红溶液中通入某种气体,使品红褪色--该气体一定是二氧化硫 |
13.下列除杂方法(括号内为杂质)和操作正确的是( )
| A. | 乙醇(水):加新制的生石灰,过滤 | |
| B. | 溴苯(苯):加水,振荡静置后分液 | |
| C. | 乙烷(乙烯):通过溴水溶液,洗气 | |
| D. | 乙酸乙酯(乙酸):加NaOH溶液,振荡静置后蒸馏 |
20.在烃类分子中,碳原子相互结合的方式不可能是( )
| A. | 形成碳链 | B. | 形成碳环 | C. | 通过离子键 | D. | 通过共价键 |
17.下列说法不正确的是( )
| A. | 常温下,等浓度的氯化铵和氟化铵溶液中铵离子浓度前者大 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| C. | 常温下,pH相等的醋酸钠和碳酸氢钠溶液前者的物质的量浓度较大 | |
| D. | 常温下,NaClO溶液中:c(HClO)+c(ClO-)=c(Na+) |
18.在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是( )
| A. | 正、逆反应速率都等于零 | B. | HI、H2、I2的浓度相等 | ||
| C. | HI、H2、I2在容器中共存 | D. | HI、H2、I2的浓度均不再变化 |