题目内容
11.下列各组离子中能大量共存,且溶液为无色透明的是( )| A. | K+、Cu2+、Cl-、AlO2- | B. | Na+、Al3+、NO3-、HCO3- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Ca2+、Cl-、CO32-、NH4+ |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.铜离子为有色离子,不满足溶液无色的条件;
B.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;
C.四种之间不发生反应,且都是无色离子;
D.钙离子与碳酸根离子反应生成碳酸钙沉淀.
解答 解:A.Cu2+为有色离子,不满足溶液无色的要求,故A错误;
B.碳酸氢根离子的酸性大于氢氧化铝,AlO2-、HCO3-之间反应生成氢氧化铝沉淀,在溶液中不能大量共存,故B错误;
C.Na+、H+、NO3-、SO42-之间不反应,且为无色溶液,在溶液中能够大量共存,故C正确;
D.Ca2+、CO32-之间反应生成难溶物碳酸钙,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,还应该注意题目所隐含的条件,如:溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
1.已知酸性H2SO3>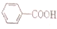 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将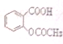 转变为
转变为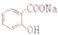 ,可行的方法是( )
,可行的方法是( )
 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
16.下列有机物中能发生消去反应,且生成物中存在同分异构体的是( )
| A. | 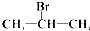 | B. |  | C. |  | D. | CH3Cl |
3.下列实验现象和对应的结论描述都正确的是( )
| A. | 往某固体中滴加稀盐酸有气泡产生--该固体一定是碳酸盐 | |
| B. | 往某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀--该溶液一定含有硫酸根离子 | |
| C. | 生石灰块投入水中,水会沸腾--生石灰变成熟石灰的过程是放热反应 | |
| D. | 往品红溶液中通入某种气体,使品红褪色--该气体一定是二氧化硫 |
20.在烃类分子中,碳原子相互结合的方式不可能是( )
| A. | 形成碳链 | B. | 形成碳环 | C. | 通过离子键 | D. | 通过共价键 |
1.下列元素中,属于惰性气体元素的是( )
| A. | .钠 | B. | 氖 | C. | .铝 | D. | .硅 |
 .
. .
. (任写一种).
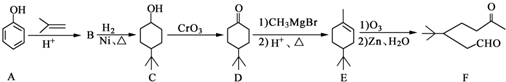
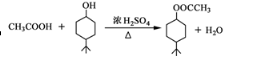
(任写一种).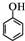 )和CH2=CH2为原料制备
)和CH2=CH2为原料制备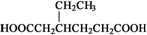 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).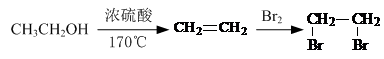
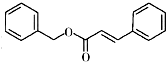 )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线: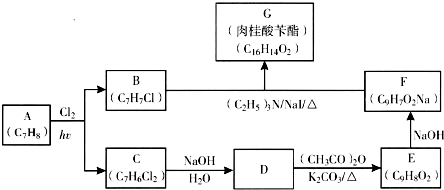
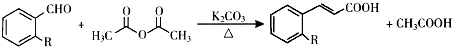
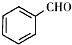 ;
;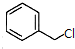 +
+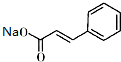 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$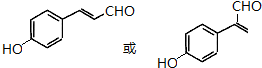 (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种).