题目内容
7.X、Y、Z、Q、E五种元素中,X原子核外的L层中有一个空轨道,Y是地壳内含量(质量分数)最高的元素,Z原子核外的M层电子数是K层的两倍,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X、Z的元素符号依次为C、Si;
(2)XY与ZY2晶体类型分别是分子晶体和原子晶体,固体时二者硬度较大的是SiO2(写化学式);
(3)XY2分子的中心原子的杂化方式是sp,空间构型为直线形,Z和E两元素所形成化合物分子的空间构型为正四面体;
(4)Q的元素符号是Ca,它属于第四周期,它的核外电子排布式为1s22s22p63s23p64s2;
(5)Q和E形成的化合物的电子式是
 ;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E两元素中第一电离能较大的是(填元素符号)F;X、Y、Q三元素可以形成一种化合物,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
分析 X原子核外的L层中有一个空轨道,核外电子排布为1s22s22p2,则X为C元素;Y是地壳内含量(质量分数)最高的元素,则Y为O元素;Z原子核外的M层电子数是K层的两倍,Z有3个电子层,最外层电子数为4,故Z为Si;Q的核电荷数是X与Z的核电荷数之和,Q原子序数为20,为Ca元素;E在元素周期表的各元素中电负性最大,应为F元素,据此答题.
解答 解:X原子核外的L层中有一个空轨道,核外电子排布为1s22s22p2,则X为C元素;Y是地壳内含量(质量分数)最高的元素,则Y为O元素;Z原子核外的M层电子数是K层的两倍,Z有3个电子层,最外层电子数为4,故Z为Si;Q的核电荷数是X与Z的核电荷数之和,Q原子序数为20,为Ca元素;E在元素周期表的各元素中电负性最大,应为F元素.
(1)由上述分析可知,X、Z的元素符号依次为C、Si,故答案为:C、Si;
(2)CO属于分子晶体,SiO2属于原子晶体,固体时二者硬度较大的是SiO2,故答案为:分子晶体;原子晶体;SiO2;
(3)CO2分子C和O形成2个δ键,没有孤电子对,为直线形结构,C原子采取sp方式杂化;Z和E两元素所形成化合物为SiCl4,Si原子形成4个δ键,没有孤电子对,为正四面体结构,
故答案为:sp;直线形;正四面体;
(4)Q的元素符号是Ca,它属于第四周期,它的核外电子排布式为1s22s22p63s23p64s2,故答案为:Ca;四;1s22s22p63s23p64s2;
(5)Q和E形成的化合物为CaF2,电子式是 ;同周期随原子序数增大,元素第一电离能呈增大趋势,故F元素第一电离能大于氧的;
;同周期随原子序数增大,元素第一电离能呈增大趋势,故F元素第一电离能大于氧的;
X、Y、Q三元素可以形成一种化合物为CaCO3,它与稀盐酸反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为: ;F;CaCO3+2H+=Ca2++CO2↑+H2O.
;F;CaCO3+2H+=Ca2++CO2↑+H2O.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、分子构型、电子式、电离能晶体类型与性质等,推断元素的种类是关键,注意理解掌握微粒空间构型的判断.

 巧学巧练系列答案
巧学巧练系列答案| A. | 原子序数:B>C>A | B. | 原子半径:B>A>C | ||
| C. | 对应气态氢化物的稳定性:A>C | D. | 还原性:Am->Cn- |
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |
| A. | 苯与氢气加成: | |
| B. | 乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |
| C. | 从海带中提取碘:H2O2+I-+H+═I2+2H2O | |
| D. | 乙醇催化氧化:2CH3CH2OH+18O2 $→_{△}^{Cu}$ 2CH3COH+2H2O |

| A. | 甲中盛硫酸锌溶液,乙中盛硫酸铜溶液,锌为阴极 | |
| B. | 乙中盛硫酸铜溶液,铜离子在铜电极上被氧化 | |
| C. | 电池工作时,盐桥中的阳离子移向甲,阴离子移向乙,溶液仍保持电中性 | |
| D. | 取出盐桥,电流表指针即回到零点 |
| A. | 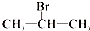 | B. | 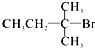 | C. | 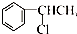 | D. | CH3Cl |
| A. | 常温下,等浓度的氯化铵和氟化铵溶液中铵离子浓度前者大 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| C. | 常温下,pH相等的醋酸钠和碳酸氢钠溶液前者的物质的量浓度较大 | |
| D. | 常温下,NaClO溶液中:c(HClO)+c(ClO-)=c(Na+) |

 .
. .
. (任写一种).
(任写一种). )和CH2=CH2为原料制备
)和CH2=CH2为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
