题目内容
10.某芳香烃A有如下转化关系,其中M是一种重要的有机合成的
按要求填空:
(l)写出反应 ②的反应条件:NaOH的醇溶液、加热;反应⑤的反应类型:消去.
(2)写出 A 和 F 的结构简式:A
 ,F
,F .
.(3)写出反应 ⑥的化学方程式:
 .
.
分析 根据合成路线图知,A发生加成反应生成B,B发生取代反应生成C,C发生氧化反应生成D,D发生氧化反应生成M,从A到M其分子中C原子个数不变,则A为 ,D与新制备氢氧化铜反应产物可知D应为
,D与新制备氢氧化铜反应产物可知D应为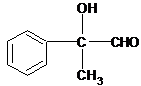

 ;由最终产物可知F为
;由最终产物可知F为
 ,据此分析解答.
,据此分析解答.
解答 解:根据合成路线图知,A发生加成反应生成B,B发生取代反应生成C,C发生氧化反应生成D,D发生氧化反应生成M,从A到M其分子中C原子个数不变,则A为 ,D与新制备氢氧化铜反应产物可知D应为
,D与新制备氢氧化铜反应产物可知D应为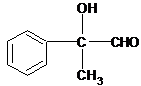

 ;由最终产物可知F为
;由最终产物可知F为
 ,
,
(1)反应②是溴原子被-OH取代,所以该反应的反应条件:NaOH的水溶液、加热;反应⑤M发生消去反应生成E,反应类型是消去反应,故答案为:NaOH水溶液加热;消去;
(2)A、F的结构简式分别为 、
、 ,
,
故答案为: ;
; ;
;
(3)E和甲醇发生酯化反应生成F,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,根据M结构结合反应条件采用正逆结合的方法进行推断,正确判断各物质结构简式是解本题关键,熟悉常见有机反应类型及反应条件,题目难度不大.

练习册系列答案
相关题目
18.1mL密度为0.93g•cm-3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气( )
| A. | 294.7L | B. | 378.0L | C. | 2240.0L | D. | 1120.0L |
1.已知酸性H2SO3>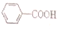 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )
 >H2CO3
>H2CO3 >HCO3-,现要将
>HCO3-,现要将 转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 加稀硫酸共热后,再加入足量NaOH溶液 | |
| C. | 加热该物质溶液,再通入足量的SO2 | |
| D. | 与稀硫酸共热后,加入足量的Na2CO3 |
18.根据原子结构及元素周期规律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | 同周期主族非金属元素随原子序数递增,原子得电子能力增强 |
15.下列化学反应方程式或离子方程式书写正确的是( )
| A. | 苯与氢气加成: | |
| B. | 乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |
| C. | 从海带中提取碘:H2O2+I-+H+═I2+2H2O | |
| D. | 乙醇催化氧化:2CH3CH2OH+18O2 $→_{△}^{Cu}$ 2CH3COH+2H2O |
20.在烃类分子中,碳原子相互结合的方式不可能是( )
| A. | 形成碳链 | B. | 形成碳环 | C. | 通过离子键 | D. | 通过共价键 |
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
 .
. .
. (任写一种).
(任写一种). )和CH2=CH2为原料制备
)和CH2=CH2为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
