题目内容
4.下列递变规律正确的是( )| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
分析 A.非金属性越强,最高价氧化物的水化物酸性最强;
B.非金属性越强,气态氢化物的稳定性越强;
C.钠、镁、铝同周期,原子序数大的金属性弱;
D.P、S、Cl最高正价均等于最外层电子数.
解答 解:A.非金属性Cl>S>P,HClO4、H2SO4、H3PO4的酸性依次减弱,故A错误;
B.非金属性Cl>Br>I,HCl、HBr、HI的稳定性依次减弱,故B错误;
C.钠、镁、铝同周期,原子序数大的金属性弱,还原性也弱,则钠、镁、铝的还原性依次减弱,故C正确;
D.P、S、Cl最高正价均等于最外层电子数,分别为+5、+6、+7,依次增大,故D错误;
故选C.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期和同主族元素的性质变化规律、金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量.已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的量可能是( )
| A. | 0.2 mol | B. | 0.6 mol | C. | 1.2 mol | D. | 2 mol |
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法不正确的是( )


| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
5.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )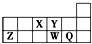

| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
9.在强酸性溶液中能大量共存的无色透明离子组是( )
| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
14.下列选项中,都是只由极性键形成的非极性分子的一组物质是( )
| A. | BCl3、CS2、SO3 | B. | CH4、CH2Cl2、BeCl2 | ||
| C. | P4、SiO2、CO2 | D. | NF3、CCl4、苯(C6H6) |
 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题: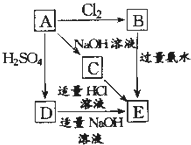 在如图式中,E是不溶于水的白色胶状物质,试推断:
在如图式中,E是不溶于水的白色胶状物质,试推断: