题目内容
9.在强酸性溶液中能大量共存的无色透明离子组是( )| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
分析 强酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe3+为黄色,与无色不符,故A错误;
B.酸溶液中不能大量存在CO32-,故B错误;
C.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故C正确;
D.酸溶液中不能大量存在ClO-,且Ba2+、SO42-结合生成沉淀不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下表中对应关系正确的是
| 化学方程式 | 结论 | |
| A | 4Cu0$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ | 热稳定性:Cu2O>CuO |
| B | 2KClO3+I2$\frac{\underline{\;\;△\;\;}}{\;}$2KIO3+Cl2 | 非金属性:I>Cl |
| C | H2S+CuSO4═CuS↓+H2SO4 | 酸性:H2S>H2SO4 |
| D | CH3COOCH2CH3+H2O?CH3COOH+CH3CH2OH | 反应类型:既是水解反应,也是加成反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |

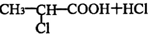
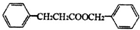 ;有机物M中含氧官能团名称是醛基.
;有机物M中含氧官能团名称是醛基. ,F→G
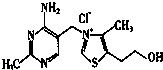
,F→G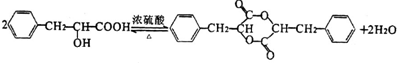 .
.
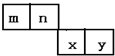 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: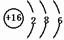 .
.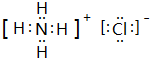 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.