题目内容
7.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量.已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的量可能是( )| A. | 0.2 mol | B. | 0.6 mol | C. | 1.2 mol | D. | 2 mol |
分析 在CuCl2和FeCl3组成的混合溶液中加入过量的铁粉,分别发生:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,充分反应后,反应完全后剩余固体的质量大于加入的铁粉质量,则消耗的铁的质量应小于于生成的铜的质量,即两个反应中固体减少质量小于固体增加质量,以此解答该题.
解答 解:设原溶液中有x mol FeCl3,y mol CuCl2,则:
2Fe3++Fe═3Fe2+ 固体减少质量△m1
2mol 56 g
x mol 28x
Cu2++Fe═Fe2++Cu 固体增加质量△m2
1mol 8 g
y mol 8y g
因反应完全后剩余固体的质量大于加入的铁粉质量,则28x g<8y g,即y>3.5x,
已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的量大于0.4mol×3.5=1.4mol,
只有D符合.
故选D.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,侧重考查学生分析计算能力,注意利用差量法进行解答.

练习册系列答案
相关题目
17.氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图所示:
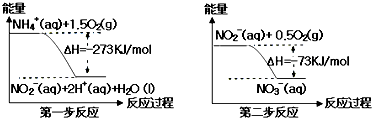
下列说法合理的是( )

下列说法合理的是( )
| A. | 该反应的催化剂是NO2- | |
| B. | 升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3- | |
| C. | 在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 | |
| D. | 1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
15.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |
2.下列说法正确的是( )
| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
19.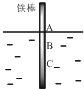 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 14g聚丙烯中含C-H键总数目为2NA | |
| B. | 1molFe与足量的稀硝酸反应转移电子总数目为2NA | |
| C. | 标准状况下,44.8L乙醛中含乙醛分子总数目为2NA | |
| D. | 常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA |
4.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
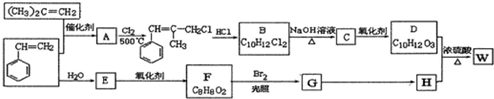
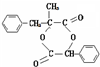 .
.  ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为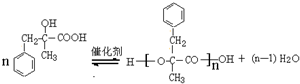 .
.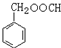 (写结构简式).
(写结构简式).

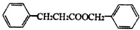 ;有机物M中含氧官能团名称是醛基.
;有机物M中含氧官能团名称是醛基.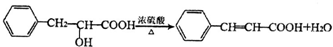 ,F→G
,F→G .
.