题目内容
12. X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:(1)X所在周期中第一电离能最大的主族元素是F(填元素符号);H2X2分子中X原子的杂化方式是sp3.
(2)Y与X可形成YX42-.
①YX42-的立体构型是正四面体.
②写出一种与YX42-互为等电子体分子的化学式CCl4等.
(3)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA.
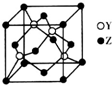
(4)Y与Z形成化合物晶体的晶胞如图所示.已知该晶体的密度为a g•cm-3,则该晶胞的体积为$\frac{388}{a{N}_{A}}$cm3(NA表示阿伏加德罗常数的值).
分析 X、Y、Z为前四周期元素且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态,则Y为O元素,形成的两种化合物为H2O、H2O2;Y基态原子的M层电子数是K层的3倍,则M层电子数为6,故Y为S元素;Z2+的3d轨道中有10个电子,Z原子核外电子数为2+8+18+2=30,故Z为Zn,据此解答.
解答 解:X、Y、Z为前四周期元素且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态,则Y为O元素,形成的两种化合物为H2O、H2O2;Y基态原子的M层电子数是K层的3倍,则M层电子数为6,故Y为S元素;Z2+的3d轨道中有10个电子,Z原子核外电子数为2+8+18+2=30,故Z为Zn.
(1)同周期随原子序数增大,第一电离能呈增大趋势,X(O元素)所在周期中第一电离能最大的主族元素是F元素;H2O2分子结构式为H-O-O-H,分子中O原子价层电子对数为2+$\frac{6-1×2}{2}$=4,故O原子的杂化方式是sp3杂化,故答案为:F;sp3;
(2)①SO42-中S原子价层电子对数为4+$\frac{6+2-2×4}{2}$=4,没有孤电子对,故为正四面体构型,故答案为:正四面体;
②原子总数相同、价电子总数相同的微粒互为等电子体,故与SO42-互为等电子体分子为CCl4等,故答案为:CCl4等;
(3)[Zn(NH3)4]Cl2中Zn2+与NH3形成4个配位键,NH3中含有3个N-H键,均为σ键,故1mol[Zn(NH3)4]Cl2含有(4+3×4)mol=16molσ键,则含有σ键的数目为16NA,故答案为:16NA;
(4)晶胞中S原子数目为4,Zn原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{32+65}{{N}_{A}}$g,晶体的密度为a g•cm-3,则该晶胞的体积为:(4×$\frac{32+65}{{N}_{A}}$g)÷a g•cm-3=$\frac{388}{a{N}_{A}}$cm3,故答案为:$\frac{388}{a{N}_{A}}$cm3.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化理论、分子构型、等电子体、化学键、晶胞计算等,难度中等,(3)为易错点,学生容易忽略配位键.

| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
| A. | X与Y形成化合物时,X可能显负价,也可能显正价 | |
| B. | 第一电离能X可能小于Y | |
| C. | X的最高价含氧酸的酸性强于Y的最高价含氧酸的酸性 | |
| D. | 原子序数X一定大于Y |
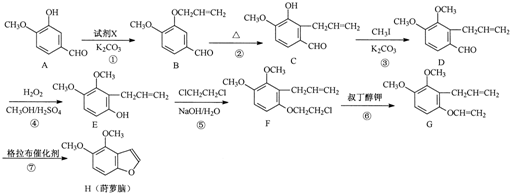
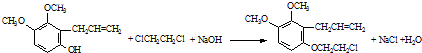 .
.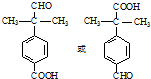 .
.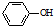 为原料制备
为原料制备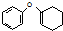 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3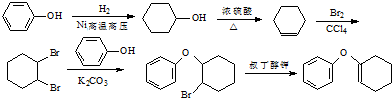 .
.
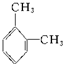 名称:邻二甲苯或1,2-二甲基苯
名称:邻二甲苯或1,2-二甲基苯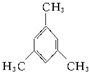 名称:1,3,5-三甲基苯.
名称:1,3,5-三甲基苯.