题目内容
16.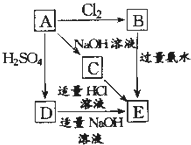 在如图式中,E是不溶于水的白色胶状物质,试推断:
在如图式中,E是不溶于水的白色胶状物质,试推断:(1)A、B、C、D、E的化学式:
AAl、BAlCl3CNaAlO2、DAl2(SO4)3、EAl(OH)3.
(2)写出下列反应的离子方程式:
①D→E:Al3++3OH-=Al(OH)3↓;
②B→E:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 A能与硫酸、氢氧化钠反应,则A为两性物质,且A能与氯气反应,故A为Al,可知B为AlCl3,氯化铝与氨水反应生成生成氢氧化铝与氯化铵,且E是不溶于水的白色胶状物质,则E为Al(OH)3,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,则C为NaAlO2,C为NaAlO2与适量的盐酸溶液反应生成氢氧化铝沉淀,Al与硫酸反应生成硫酸铝与氢气,而D能与适量的氢氧化钠溶液反应生成E(氢氧化铝),故D为Al2(SO4)3,据此解答.
解答 解:A能与硫酸、氢氧化钠反应,则A为两性物质,且A能与氯气反应,故A为Al,可知B为AlCl3,氯化铝与氨水反应生成生成氢氧化铝与氯化铵,且E是不溶于水的白色胶状物质,则E为Al(OH)3,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,则C为NaAlO2,C为NaAlO2与适量的盐酸溶液反应生成氢氧化铝沉淀,Al与硫酸反应生成硫酸铝与氢气,而D能与适量的氢氧化钠溶液反应生成E(氢氧化铝),故D为Al2(SO4)3,
(1)上述分析可知A为Al,B为AlCl3,C为NaAlO2,D为Al2(SO4)3,E为Al(OH)3,故答案为:Al;AlCl3;NaAlO2;Al2(SO4)3;Al(OH)3;
(2)①D-E是硫酸铝和适量的氢氧化钠溶液反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,
故答案为:Al3++3OH-=Al(OH)3↓;
②反应B-E的反应是氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵,属于离子反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
点评 本题考查无机物推断,涉及Al元素单质化合物性质与转化,A发生的反应是推断突破口,再结合转化关系推断,侧重对化学方程式的考查,难度中等.

 考前必练系列答案
考前必练系列答案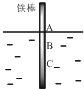 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
| A. | 氧化剂 | B. | 还原剂 | C. | 催化剂 | D. | 反应物 |
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
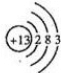
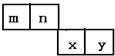 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: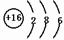 .
.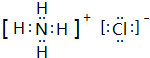 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.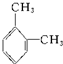 名称:邻二甲苯或1,2-二甲基苯
名称:邻二甲苯或1,2-二甲基苯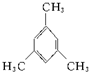 名称:1,3,5-三甲基苯.
名称:1,3,5-三甲基苯.