题目内容
5.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )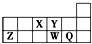
| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
分析 根据元素在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,最高价含氧酸的酸性越强;
C.元素X与Q的氢化物化合的产物为NH4Cl;
D.X、Z、W、Q四种元素的最高价氧化物对应的水化物分别为硝酸、氢氧化铝、硫酸、高氯酸.
解答 解:根据元素在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(O2-)>r(Al3+),故A正确;
B.非金属性Q>W,非金属性越强,最高价含氧酸的酸性越强,故B错误;
C.元素X与Q的氢化物化合的产物为NH4Cl,含有离子键、共价键,故C正确;
D.X、Z、W、Q四种元素的最高价氧化物对应的水化物分别为硝酸、氢氧化铝、硫酸、高氯酸,均能与氢氧化钠反应,故D正确,
故选B.
点评 本题考查位置结构性质关系及应用,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.

练习册系列答案
相关题目
15.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 14g聚丙烯中含C-H键总数目为2NA | |
| B. | 1molFe与足量的稀硝酸反应转移电子总数目为2NA | |
| C. | 标准状况下,44.8L乙醛中含乙醛分子总数目为2NA | |
| D. | 常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA |
10.下表中对应关系正确的是
| 化学方程式 | 结论 | |
| A | 4Cu0$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ | 热稳定性:Cu2O>CuO |
| B | 2KClO3+I2$\frac{\underline{\;\;△\;\;}}{\;}$2KIO3+Cl2 | 非金属性:I>Cl |
| C | H2S+CuSO4═CuS↓+H2SO4 | 酸性:H2S>H2SO4 |
| D | CH3COOCH2CH3+H2O?CH3COOH+CH3CH2OH | 反应类型:既是水解反应,也是加成反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
2.下列各组元素中原子序数按由大到小的顺序排列的是( )
| A. | Be.C.B | B. | Li.O.Cl | C. | S.Si.Al | D. | C.S.Mg |
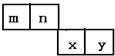 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: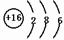 .
.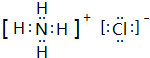 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.