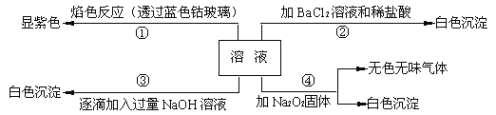
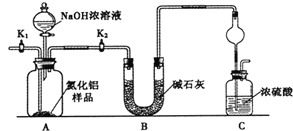
题目内容
【题目】可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。
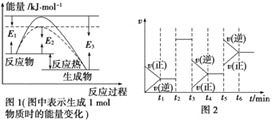
(1)根据图1请写出合成氨的热化学方程式__________________(热量用El、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的_________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1……t6”表示)。
(3)图2中t3时刻改变的条件是_________,t5与时刻改变的条件是_________。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H=-2(E3-E1) kJ/mol 催化剂 t2 或t2~t3 减小压强 升高温度
2NH3(g) △H=-2(E3-E1) kJ/mol 催化剂 t2 或t2~t3 减小压强 升高温度
【解析】(1)由图可知该反应为放热反应,且生成1mol生成物放出的热量为(E3-E1)kJ,则生成2mol生成物放热为2(E3-E1)kJ,即该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-2(E3-E1)kJ/mol;(2)图1中虚线部分改变了反应的途径,从而降低了反应所需的活化能,但反应热不变,则改变的条件应为使用催化剂,加入催化加只能改变反应速率,但是不会引起平衡的移动,和图2中t2~t3时刻条件的改变相同;(3)由图2可知t3-t4阶段正逆反应速率均减慢,平衡逆向进行,应该是减小压强导致,t5-t6时正逆反应速率均增大,化学平衡逆向移动,应该是升高温度的缘故。
2NH3(g) △H=-2(E3-E1)kJ/mol;(2)图1中虚线部分改变了反应的途径,从而降低了反应所需的活化能,但反应热不变,则改变的条件应为使用催化剂,加入催化加只能改变反应速率,但是不会引起平衡的移动,和图2中t2~t3时刻条件的改变相同;(3)由图2可知t3-t4阶段正逆反应速率均减慢,平衡逆向进行,应该是减小压强导致,t5-t6时正逆反应速率均增大,化学平衡逆向移动,应该是升高温度的缘故。

【题目】硫及其化合物对人类的生产和生活有着重要的作用.
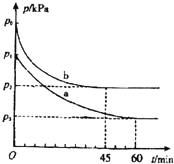
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .