题目内容
【题目】硫及其化合物对人类的生产和生活有着重要的作用.
2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1是制备硫酸的重要反应.
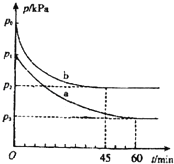
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)SO3(g)+NO(g)△H=﹣42kJmol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .
【答案】(1)升高温度;实验b与a相比,反应速率快,平衡向逆反应方向移动(2)①0.05mol/(L.min);2.613;②![]() ×100%;③<;T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2
×100%;③<;T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2
【解析】
(1)恒实验b到达平衡时总压强变大,说明平衡逆向移动,而化学反应速率变大,考虑到该反应是放热反应,可能是升高温度所导致
(2)①实验甲中,若2min时测得放出的热量是4.2kJ,则消耗二氧化硫物质的量为![]() =0.1mol,则v(SO2)=
=0.1mol,则v(SO2)= =0.05mol/(L.min);
=0.05mol/(L.min);
平衡时NO为0.18mol,则:
SO2(g)+NO2(g)SO3(g)+NO(g)
起始量(mol):0.8 0.2 0 0
变化量(mol):0.18 0.18 0.18 0.18
平衡量(mol):0.62 0.02 0.18 0.18
T1温度下平衡常数K=![]() =
=![]() =2.613,
=2.613,
②实验丙中,平衡时NO为a mol,则参加反应二氧化氮的物质的量为amol,故二氧化氮的转化率为![]() ×100%=
×100%=![]() ×100%,
×100%,
③乙实验平衡时,NO为0.16mol,则:
SO2(g)+NO2(g)SO3(g)+NO(g)
起始量(mol):0.2 0.8 0 0
变化量(mol):0.16 0.16 0.16 0.16
平衡量(mol):0.04 0.64 0.16 0.16
T2温度下平衡常数K=![]() =
=![]() =1,
=1,
正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故T1<T2,

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案