��Ŀ����
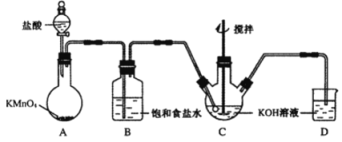
����Ŀ��ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣨�ס��ҡ������������������������պϸ�װ�õĵ��Kʱ���۲쵽�����Ƶ�ָ�뷢����ƫת��

��ش��������⣺
��1���׳�Ϊ ���ԭ��ء��������ء���Ƴء�����A�缫�ĵ缫��ӦʽΪ ��
��2��������F�缫Ϊ ������������������������������������������óص��ܷ�Ӧ����ʽΪ ��
��3�����ҳ���C����������10.8gʱ���׳���B�缫����������O2�����Ϊ mL����״������
��4��һ��ʱ��Ͽ����K������������ʹ�ҳػָ�����ӦǰŨ�ȵ��� ����ѡ����ĸ����
A��Cu
B��CuO
C��Cu��OH��2
D��Cu2��OH��2CO3��
���𰸡���1��ԭ��أ�CH3OH+8OH����6e��=CO32��+6H2O��
��2��������2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����
2H2SO4+2Cu+O2����
��3��560��
��4��A��
��������
�����������1���׳����Է�����������ԭ��ӦΪԭ��أ�ȼ�ϵ���У�ȼ��ʧ���ӷ���������Ӧ��
��2�������ǵ��أ�E��������F�����������������������ӷŵ磬������ͭ���ӷŵ磻
��3�����ݴ�����·��ת�Ƶ�����ȼ��㣻
��4�����ݡ�����ʲô����ʲô����ԭ��������ʣ�
�⣺��1���׳����Է�����������ԭ��ӦΪԭ��أ�ȼ�ϵ���У�ȼ��ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OH+8OH����6e���TCO32��+6H2O��
�ʴ�Ϊ��ԭ��أ�CH3OH+8OH����6e��=CO32��+6H2O��
��2��F����ԭ��ظ���������Ϊ���������������������ӷŵ磬������ͭ���ӷŵ磬��ط�ӦʽΪ��2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����
2H2SO4+2Cu+O2����
�ʴ�Ϊ��������2CuSO4+2H2O![]() 2H2SO4+2Cu+O2����
2H2SO4+2Cu+O2����
��3��C���ϵĵ缫��ӦΪ��Ag��e���TAg+��B�缫�ϵĵ缫��ӦΪ��O2+2H2O+4e���T4OH����������C����������10.8gʱ����ת�Ƶ�����0.1mol����ʱ�׳���B�缫����������O2�����ʵ�����0.025mol�����Ϊ0.025mol��22.4L/mol=0.56L=560mL��
�ʴ�Ϊ��560��
��4���ҳ��ӵ������ͭ���û��õ缫������Ϊ��������������������ͭ���ӵõ������ɽ���ͭ�ķ�Ӧ����Һ�м�����CuԪ�ص�����������Ҫ�õ���ʸ�ԭ����Ҫ�������ͭ��
��ѡ��A��