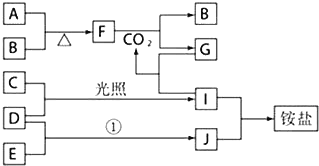
题目内容
【题目】有一无色溶液,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:

第③个实验中,生成白色沉淀的量与加入![]() 的量有如下图所示的相互关系。据此可知:
的量有如下图所示的相互关系。据此可知:

(1)在原溶液中一定存在的离子有______;一定不存在的离子有______;不能确定是否存在的离子有______。
(2)写出第③个实验中发生反应的离子方程式____________________________________。
【答案】Al3+、Mg2+、K+、![]() Fe3+、Fe2+、Cu2+、Ba2+ Cl Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===
Fe3+、Fe2+、Cu2+、Ba2+ Cl Mg2++2OH===Mg(OH)2↓、Al3++3OH===Al(OH)3↓、Al(OH)3+OH===![]() +2H2O
+2H2O
【解析】
由题意,溶液无色,则Fe3+(棕黄色)、Fe2+(浅绿色)、Cu2+(蓝色)一定不存在;焰色反应显紫色,说明一定有K+;实验②说明一定有![]() ,则Ba2+一定不存在;由实验③以及图像可知一定有Mg2+、Al3+,而Cl通过上述四个实验无法确定。
,则Ba2+一定不存在;由实验③以及图像可知一定有Mg2+、Al3+,而Cl通过上述四个实验无法确定。
(1)由上述分析可知,在原溶液中一定存在的离子有Al3+、Mg2+、K+、![]() ,一定不存在的离子有Fe3+、Fe2+、Cu2+、Ba2+,不能确定是否存在的离子有Cl;
,一定不存在的离子有Fe3+、Fe2+、Cu2+、Ba2+,不能确定是否存在的离子有Cl;
(2) 在原溶液中存在的离子Al3+、Mg2+,加入足量氢氧化钠溶液时,生成氢氧化镁沉淀,过量的氢氧化钠使铝离子生成偏铝酸根,溶液中发生反应的离子方程式为Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目