题目内容
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
分析 A、依据等物质的量的SO2气体和Cl2同时作用于湿润的红色布条发生反应Cl2+SO2+2H2O=H2SO4+2HCl分析;
B、二氧化硫漂白性是和无色物质结合生成不稳定的无色物质,加热恢复原来的颜色,氯气无漂白性,遇到水反应生成的次氯酸具有漂白性是次氯酸的强氧化性;
C、二氧化硫和氯气都是有毒气体;
D、二氧化硫中硫元素化合价处于中间价态,化合价可以升高,也可以降低;
解答 解:A、依据等物质的量的SO2气体和Cl2同时作用于湿润的红色布条发生反应Cl2+SO2+2H2O=H2SO4+2HCl,此时无漂白性,故A错误;
B、二氧化硫漂白性是和无色物质结合生成不稳定的无色物质,加热恢复原来的颜色,氯气无漂白性,遇到水反应生成的次氯酸具有漂白性是次氯酸的强氧化性,SO2气体和Cl2 漂白原理不相同,故B错误;
C、二氧化硫和氯气都是有毒气体,故C正确;
D、二氧化硫中硫元素化合价处于中间价态,化合价可以升高,也可以降低,既具有氧化性也具有还原性,故D错误;
故选C.
点评 本题考查了物质性质的分析应用,主要是二氧化硫和氯气的漂白性的实质理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
19.某条件下,恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应),下列说法正确的是( )
| A. | 用高效催化剂,可提高CO2的利用率 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的利用率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: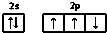 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
17.下列性质能肯定该物质为离子化合物的是( )
| A. | 第ⅠA族与第ⅦA族元素形成的化合物 | B. | 溶于水中能导电的化合物 | ||
| C. | 在熔化状态下能导电的化合物 | D. | 熔点高的化合物 |
4.下列装置或操作能达到实验目的是( )
| A. |  实验室制取并收集NH3 | B. | 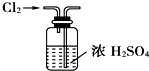 干燥Cl2 | ||
| C. | 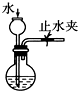 检查装置气密性 | D. |  利用排空气法收集CO2 |
14.下列各组元素性质递变规律不正确的是( )
| A. | N、O、F原子半径依次增大 | |
| B. | P、S、Cl元素最高化合价依次增高 | |
| C. | Li、Be、B三种元素的原子随着原子序数的增加最外层电子数依次增多 | |
| D. | Na、K、Rb的金属性依次增强 |
1.元素周期表的一部分,针对表中的①…⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的元素是F,(填元素符号);
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为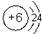 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为
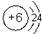 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
19.下列各装置图的叙述不正确的是( )


| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |