题目内容
19.某条件下,恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应),下列说法正确的是( )| A. | 用高效催化剂,可提高CO2的利用率 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的利用率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
分析 A、催化剂对化学平衡无影响;
B、根据正逆反应速率是否相等平衡是否达到平衡状态;
C、根据平衡移动原理分析反应物减少对化学平衡的影响;
D、根据温度对该反应的影响判断升高温度,该反应的平衡常数变化.
解答 解:A、催化剂只影响反应速率,不影响化学平衡,所以使用催化剂,化学平衡不移动,二氧化碳的转化率不变,故A错误;
B、单位时间内消耗CO2和H2的物质的量比为1:3时,表示的都是正反应速率,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故B错误;
C、及时分离出CH3OH和H2O,化学平衡向着正向移动,反应物CO2和H2的转化率增大,故C正确;
D、该反应为放热反应,升高温度,平衡向着逆向移动,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断、化学平衡的影响因素等知识,题目难度中等,注意掌握判断化学平衡状态的方法、催化剂只影响反应速率,不影响化学平衡的移动.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
9.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的气体是( )
| A. | NH3 | B. | Cl2 | C. | NO | D. | HCl |
14.下列叙述中,通常不能作为判断两种元素非金性强弱的依据的是( )
| A. | 其气态氢化物的稳定性 | |
| B. | 单质的氧化性的强弱 | |
| C. | 其最高价氧化物对应的水化物的酸碱性 | |
| D. | 单质的熔点高低 |
4.下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
11.下列离子方程式正确的是( )
| A. | 向水中通入氯气:Cl2+H2O═H++Cl-+HClO | |
| B. | 向明矾溶液中加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至溶液恰好呈中性:Ba2++OH一+SO42-+H+═BaSO4↓+H2O | |
| D. | 溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br+OH-CH2═CH2↑+Br-+H2O |
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )
| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
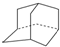 与金刚烷互为同分异构体的是( )
与金刚烷互为同分异构体的是( )