题目内容
20.下列描述中正确的是( )| A. | 氮原子的价电子排布图: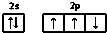 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
分析 A.由洪特规则可知,电子优先占据1个轨道,且自旋方向相同;
B.3p轨道的能量大于2p轨道的能量;
C.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
D.原子由基态变成激发态需要吸收能量.
解答 解:A.根据“洪特规则”可知,2p轨道电子的自旋方向应该相同,正确的电子排布图为: ,故A错误;
,故A错误;
B.2p和3p轨道形状均为哑铃形,但是原子轨道离原子核越远,能量越高,2p轨道能量低于3p,故B错误;
C.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故C正确;
D.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,故D错误;
故选C.
点评 本题考查原子核外电子的排布、原子核外电子的跃迁,题目难度中等,注意掌握样子核外电子的跃迁过程中能量变化,勉强强电子排布规律及电子排布与元素位置的关系,注意规律性知识的总结和应用.

练习册系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 向水中通入氯气:Cl2+H2O═H++Cl-+HClO | |
| B. | 向明矾溶液中加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 硫酸氢钠溶液中逐滴加入氢氧化钡溶液,至溶液恰好呈中性:Ba2++OH一+SO42-+H+═BaSO4↓+H2O | |
| D. | 溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br+OH-CH2═CH2↑+Br-+H2O |
15. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:2X(g)+2Y(g)?Z(g) |
5.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2?2NH3,下列关于该反应的说法中正确的是( )
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
12.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | |
| B. | 原子最外层电子数为2的元素一定位于周期表第ⅡA族 | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为  |
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )
| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
10.下列现象或事实可用同一原理解释的是( )
| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |