题目内容
17.下列性质能肯定该物质为离子化合物的是( )| A. | 第ⅠA族与第ⅦA族元素形成的化合物 | B. | 溶于水中能导电的化合物 | ||
| C. | 在熔化状态下能导电的化合物 | D. | 熔点高的化合物 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,离子化合物在熔融状态下能电离出阴阳离子而导电,据此分析解答.
解答 解:A.第ⅠA族与第ⅦA族元素形成的化合物可能是共价化合物,如HCl、HI等都是共价化合物,故A错误;
B.溶于水能导电的化合物可能是共价化合物,如硫酸等,故B错误;
C.在熔化状态下能导电的化合物中含有自由移动的离子,所以一定是离子化合物,故C正确;
D.熔点高的化合物可能是原子晶体,如金刚石等,故D错误;
故选C.
点评 本题考查离子化合物的判断,侧重考查基本概念,明确离子化合物和共价化合物的根本区别是熔融状态下是否导电即可解答,题目难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2?2NH3,下列关于该反应的说法中正确的是( )
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
12.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | |
| B. | 原子最外层电子数为2的元素一定位于周期表第ⅡA族 | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为  |
2.下列关于化学反应限度的叙述错误的是( )
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )
| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
6.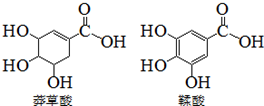 莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
 莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A. | 两种酸遇三氯化铁溶液都显色 | |
| B. | 鞣酸分子比莽草酸分子多两个双键 | |
| C. | 等物质的量的两种酸与NaOH反应,消耗NaOH的量相同 | |
| D. | 两种酸都能与溴水反应 |
7.下列关于碱金属、卤素的描述正确的是( )
| A. | 碱金属在空气中加热均可生成多种氧化物 | |
| B. | 碱金属与水反应,均浮在水面上. | |
| C. | 卤素各单质都能和水剧烈反应. | |
| D. | 卤素单质越活泼,其熔沸点就越低 |
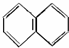
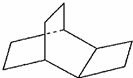
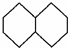
 与金刚烷互为同分异构体的是( )
与金刚烷互为同分异构体的是( )