题目内容
19.下列各装置图的叙述不正确的是( )
| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |
分析 A、电解精炼铜,粗铜做阳极,精铜做阴极;
B、盐桥是起到平衡电解质液的电荷守恒,甲池中锌离子增多,氯离子移向甲池;
C、电解阴极被保护;
D、两个原电池中使铝和稀硫酸反应,锌和稀硫酸反应电子转移相同时铝和锌物质的量不同.
解答 解:A、电解精炼铜,粗铜做阳极,精铜做阴极,用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液,故A正确;
B、盐桥是起到平衡电解质液的电荷守恒,甲池中锌离子增多,氯离子移向甲池;图②装置盐桥中KCl的Cl-移向甲烧杯,故B正确;
C、图③装置中钢闸门应与外接电源的负极相连获得保护,电解阴极被保护,故C正确;
D、两个原电池中使铝和稀硫酸反应,锌和稀硫酸反应电子转移相同时铝和锌物质的量不同,图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量之比为2:3,质量不同,故D错误;
故选D.
点评 本题考查了原电池和电解池的工作原理应用,主要考查电解精炼铜、原电池盐桥作用,电解阴极保护的原理,题目难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )
| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
10.下列现象或事实可用同一原理解释的是( )
| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
7.下列关于碱金属、卤素的描述正确的是( )
| A. | 碱金属在空气中加热均可生成多种氧化物 | |
| B. | 碱金属与水反应,均浮在水面上. | |
| C. | 卤素各单质都能和水剧烈反应. | |
| D. | 卤素单质越活泼,其熔沸点就越低 |
11.下列化学用语正确的是( )
| A. | Cl-的结构示意图: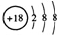 | |
| B. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
8.已知C3N4晶体可能具有比金刚石还大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是( )
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
8.电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示.下列有关说法错误的是( )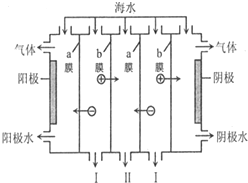

| A. | 阳极可发生电极反应:2Cl--2e-═Cl2↑ | |
| B. | 阴极附近溶液的pH减小 | |
| C. | a膜为阴离子交换膜,b膜为阳离子交换膜 | |
| D. | I、II分别是淡水、浓海水出口 |