题目内容
4.下列装置或操作能达到实验目的是( )| A. | 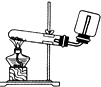 实验室制取并收集NH3 | B. | 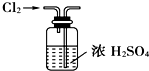 干燥Cl2 | ||
| C. | 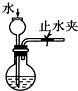 检查装置气密性 | D. | 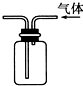 利用排空气法收集CO2 |
分析 A.收集氨气的试剂瓶不能密封;
B.干燥气体时导管长进短出;
C.关闭止水夹,利用漏斗下端与烧瓶内液面差检验气密性;
D.二氧化碳的密度比空气密度大.
解答 解:A.收集氨气的试剂瓶不能密封,可在试剂瓶口放一团棉花,故A错误;
B.干燥气体时导管长进短出,图中气体的进入方向不合理,故B错误;
C.关闭止水夹,从长颈漏斗注入水,当漏斗下端与烧瓶内液面差的高度在一段时间不变,可知气密性良好,故C正确;
D.二氧化碳的密度比空气密度大,应从长导管进入,选择向上排空气法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及除杂、气密性检验等实验基本操作及常见气体的制备实验等,把握物质的性质、反应原理及实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的分析,题目难度不大.

练习册系列答案
相关题目
14.下列叙述中,通常不能作为判断两种元素非金性强弱的依据的是( )
| A. | 其气态氢化物的稳定性 | |
| B. | 单质的氧化性的强弱 | |
| C. | 其最高价氧化物对应的水化物的酸碱性 | |
| D. | 单质的熔点高低 |
15.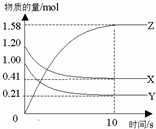 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:2X(g)+2Y(g)?Z(g) |
12.下列各项表达中正确的是( )
| A. | Na2O2的电子式为 | |
| B. | 原子最外层电子数为2的元素一定位于周期表第ⅡA族 | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为 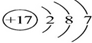 |
19.在下列影响化学反应速率的外界因素中,肯定能增大化学反应速率的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
| A. | 只有①②④ | B. | 只有②④ | C. | 只有①②③④ | D. | 全部 |
9.已知,SO2气体和Cl2均具有漂白性,二者能发生反应如下:Cl2+SO2+2H2O=H2SO4+2HCl.下列叙述正确的是( )
| A. | 将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,漂白效果将更好 | |
| B. | SO2气体和Cl2 漂白原理相同 | |
| C. | SO2气体和Cl2均是有毒气体 | |
| D. | SO2只有氧化性没有还原性 |
16.原子序数11~17号的元素,随着核电荷数的递增而逐渐变小的是( )
| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.