题目内容
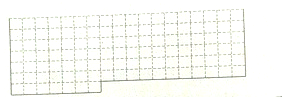
8. 25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol/L | |
| B. | HCl溶液滴加一半时,溶液pH>7 | |
| C. | 0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
分析 A、n(HCO3-)=0.001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠;
B、HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性;
C、根据溶液的电荷守恒判断;
D、在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱;
解答 解:A、n(HCO3-)=0.0001mol时,溶液的pH=8,所以加入0.1mol/LHCl溶液10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,所以溶液中NaHCO3的物质的量浓度为0.05mol/L,故A错误;
B、HCl溶液滴加一半时,也就是10mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性,所以溶液的pH>7,故B正确;
C、Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C正确;
D、在M点:n(CO32-)=n(HCO3-)=0.0005时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱,所以离子浓度大小为:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),故D正确;
故选A.
点评 本题考查了离子浓度大小的比较,为高频考点,侧重于学生的分析能力的考查,注意根据物料守恒、电荷守恒来分析解答,难点是B,注意把握图象曲线的变化特点,难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
18.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 稀硫酸、澄清的石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
16.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
6.下列各选项中的反应①与反应 ②能用同一离子方程式表示的是( )
| 序号 | 反应① | 反应② |
| A | NaOH与HCl反应 | Mg(OH)2与HNO3反应 |
| B | 向BaCl2溶液中滴加稀H2SO4 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| C | Cl2通入NaOH溶液中 | Cl2通入澄清石灰水中 |
| D | Fe与HCl反应 | Fe与CH3COOH反应 |
| A. | A | B. | B | C. | C | D. | D |
3.碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
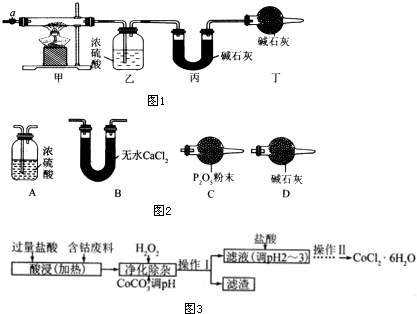
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
则该碱式碳酸钴的化学式为Co2(OH)4(CO3)2.
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
4.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |