题目内容
16.下列实验能获得成功的是( )| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
分析 A.苯和液溴在铁作催化剂条件下生成溴苯;
B.卤代烃的卤原子检验中,加入硝酸银溶液之前应该加入稀硝酸中和剩余的碱;
C.甲烷和氯气在光照条件下发生取代反应生成多种卤代烃;
D.乙烯和溴发生加成反应生成1,2-二溴乙烷.
解答 解:A.苯和液溴在铁作催化剂条件下生成溴苯,和溴水不反应,但苯能萃取溴水中的溴,故A错误;
B.卤代烃的卤原子检验中,加入硝酸银溶液之前应该加入稀硝酸中和剩余的碱,如果直接加入硝酸银溶液会生成AgOH而干扰实验,故B错误;
C.甲烷和氯气在光照条件下发生取代反应生成多种卤代烃,同时还生成HCl,所以不能得到纯净物一氯甲烷,故C错误;
D.乙烯和溴发生加成反应生成1,2-二溴乙烷,所以能得1,2-二溴乙烷,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高考高频点,明确实验原理是解本题关键,侧重考查官能团检验、物质的制备等知识点,从实验的评价性、原理分析解答,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
6.下列说法中,正确的是 ( )
| A. | 构成分子晶体的微粒中一定含有共价键 | |
| B. | 在结构相似的情况下,原子晶体中的共价键越强,晶体的熔沸点越高 | |
| C. | 某分子晶体的熔、沸点越高,分子晶体中共价键的键能越大 | |
| D. | 分子晶体中只存在分子间作用力而不存在任何化学键,所以其熔、沸点一般较低 |
4.下列各组物质之间不能通过一步就能实现a→b→c→d→a转化的是( )
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Na | Na2O2 | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
11.某同学取一定量某工厂所排废水试样,进行如下实验:
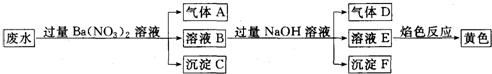
已知废水试样中可能含有下表离子中若干种.
下列判断不正确的是( )
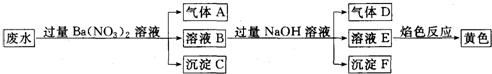
已知废水试样中可能含有下表离子中若干种.
| 阳离子 | Ba2+、K+、NH4+、Fe2+、Fe3+、X |
| 阴离子 | CO32-、SO32-、NO3-、Y |
| A. | 离子X是H+,离子Y是SO42- | |
| B. | 不能确定NO3-是否存在与废水中 | |
| C. | 沉淀C是纯净物 | |
| D. | 废水中一定存在Fe2+、NH4+,可能存在K+ |
1.用NA表示伏伽德罗常数的值,下列说法错误的是( )
| A. | 常温常压下28g氮气含有的原子数是2NA | |
| B. | 标准状况下,22.4L醋酸的水分子数是NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 500mL 2mol•L-1Al(SO4)3溶液中SO42-的数目为3NA |
8. 25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
 25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol/L | |
| B. | HCl溶液滴加一半时,溶液pH>7 | |
| C. | 0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
11.下列晶体中,不是六个原子构成的最小环的是( )
| A. | 金刚石 | B. | 石墨 | C. | 水晶 | D. | 晶体硅 |
12.从实验测得不同物质中氧氧之间的键长和键能的数据:
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是( )
| O-O键 数据 | O22- | O2- | O2 | O2+ |
| 键长(10-12 m) | 149 | 128 | 121 | 112 |
| 键能(kJ•mol-1) | x | y | z=494 | w=628 |
| A. | 成键的电子数越多,键能越大 | B. | 键长越长,键能越小 | ||
| C. | 成键所用的电子数越少,键能越大 | D. | 成键时电子对越偏移,键能越大 |
