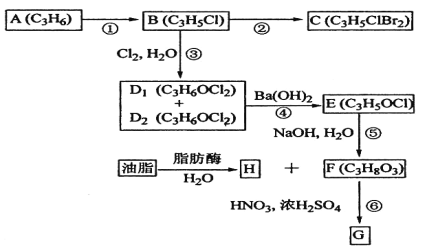
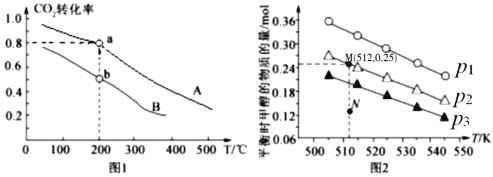
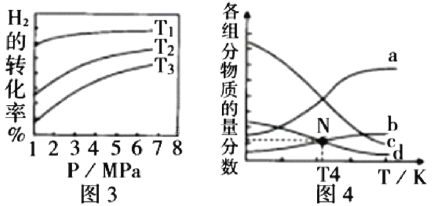
题目内容
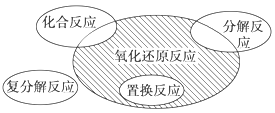
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
【答案】D
【解析】
根据题意,阴影部分只属于氧化还原反应,与四种基本反应无关。
A. Cl2+2KBr=Br2+2KCl属于氧化还原反应,同时也属于置换反应,故A不符合题意;
B. 2NaHCO3![]() Na2CO3+H2O+CO2↑反应中没有元素化合价发生变化,不属于氧化还原反应,故A不符合题意;
Na2CO3+H2O+CO2↑反应中没有元素化合价发生变化,不属于氧化还原反应,故A不符合题意;
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3属于氧化还原反应,同时也属于化合反应,故A不符合题意;
D. 2Na2O2+2CO2=2Na2CO3+O2属于氧化还原反应,与四种基本反应类型无关,故D符合题意;
答案选D。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
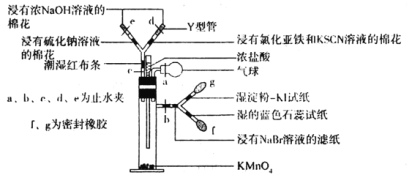
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。