题目内容
【题目】微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。
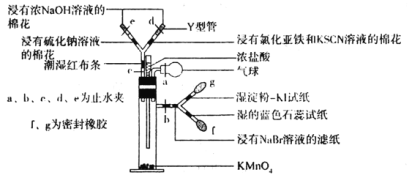
回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________。
(2)加入浓盐酸后试管内发生反应的化学方程式是__________________________________。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:___________
操作步骤 | 实验现象 |
缓慢加入浓盐酸,打开c、d、e,使产生的氯气缓慢充入Y试管 | |
关闭c打开b,使氯气缓慢进入Y管中 |
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是__________________________________________________。
(5)此装置___________(填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是__________________________。
【答案】分液漏斗 2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O 潮湿的红色布条褪色;浸有Na2S溶液的棉花出现淡黄色的S;浸有氯化亚铁和KSCN溶液的棉花变为红色;浸有氢氧化钠溶液的棉花无明显现象 湿润的淀粉碘化钾试纸变为蓝色;浸有NaBr溶液的滤纸变为红棕色;浸有湿润的蓝色石蕊试纸变为红色;氯气过量,与水结合生成HCl和HClO,HClO具有漂白性 不能 该装置只能Cl2的氧化性强于Br2,Cl2的氧化性强于I2,但不能证明Br2的氧化性强于I2, 将装置内的氯气赶入Y型管,使其完全被吸收,减少污染
【解析】
(1)装置中可用分液漏斗滴加浓盐酸;
(2)浓盐酸与高锰酸钾溶液反应,生成氯化钾、氯气、氯化锰和水;
(3)打开c、d、e,氯气逐渐进入Y型管中,Cl2与水结合生成HCl和HClO,HClO具有漂白性,Cl2具有氧化性,能与Na2S发生氧化还原反应,能将Fe2+氧化为Fe3+,Cl2与NaOH发生反应,生成NaCl和NaClO;Cl2具有氧化性,能将I-氧化为I2,能将Br-氧化为Br2,Cl2与水结合生成HCl和HClO,石蕊遇酸变色;
(4)少量的氯气遇淀粉碘化钾试纸会变为蓝色,当氯气过量时,氯气与生成的I2反应生成HIO3;
(5)欲证明氧化性顺序Cl2>Br2>I2,需证明Cl2的氧化性强于Br2,Br2的氧化性强于I2;关闭止水夹b,打开a、c,挤压气球,可将气体全部压入Y型管中,与氢氧化钠、硫化钠、氯化亚铁等物质充分反应。
(1)实验室中可代替图中添加浓盐酸的仪器名称是分液漏斗;
(2)浓盐酸与高锰酸钾溶液反应,生成氯化钾、氯气、氯化锰和水,反应方程式为:2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O;
(3)打开c、d、e,氯气逐渐进入Y型管中,Cl2与水结合生成HCl和HClO,HClO具有漂白性,Cl2具有氧化性,能与Na2S发生氧化还原反应,能将Fe2+氧化为Fe3+,Cl2与NaOH发生反应,生成NaCl和NaClO,因此可观察到潮湿的红色布条褪色;浸有Na2S溶液的棉花出现淡黄色的S;浸有氯化亚铁和KSCN溶液的棉花变为红色;浸有氢氧化钠溶液的棉花无明显现象; Cl2具有氧化性,能将I-氧化为I2,能将Br-氧化为Br2,Cl2与水结合生成HCl和HClO,石蕊遇酸变色,关闭c打开b,使氯气缓慢进入Y管中,可观察到湿润的淀粉碘化钾试纸变为蓝色;浸有NaBr溶液的滤纸变为黄色;浸有湿润的蓝色石蕊试纸变为红色最终褪色;
(4)少量的氯气遇淀粉碘化钾试纸会变为蓝色,当氯气过量时,氯气与水结合生成HCl和HClO,HClO具有漂白性,淀粉碘化钾逐渐变为无色;
(5)该装置只能Cl2的氧化性强于Br2,Cl2的氧化性强于I2,但不能证明Br2的氧化性强于I2,因此该装置不能证明氧化性顺序Cl2>Br2>I2;打开a、c,挤压气球,可将气体全部压入Y型管中,被氢氧化钠、硫化钠、氯化亚铁等物质充分吸收,可减少环境污染。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
该学习小组按下图装置进行实验(部分夹持装置省去)

(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
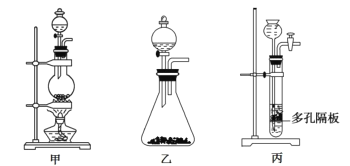
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
实验内容 | 实验现象 | |
实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000molL-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2![]() =2I-+
=2I-+![]() )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
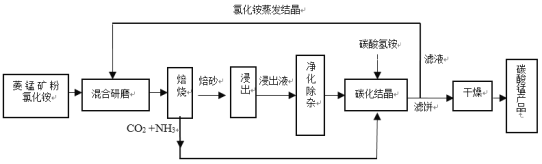
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。