题目内容
【题目】向20mL、0.2mol/LNaOH溶液中,缓缓通入一定量CO2气体,将溶液在一定条件下蒸干。
(1)若得到白色固体是纯净物,则通入的CO2的体积为__mL或__mL(标况)。写出有关的离子方程式:__、__。
(2)将上述白色固体加水溶解,加盐酸至pH=7再蒸干得白色固体质量为__g。
【答案】44.8 89.6 2OH-+CO2=CO32-+H2O(和44.8对应) OH-+CO2=HCO3-(和89.6对应) 0.234
【解析】
(1)NaOH和CO2反应生成的盐可能是Na2CO3或NaHCO3,得到白色固体是纯净物,说明NaOH反应完,反应后溶液蒸干所得固体全为Na2CO3或全为NaHCO3,可根据题给NaOH的量分别计算;
(2)Na2CO3和NaHCO3都能和盐酸反应生成NaCl,可利用Na元素守恒进行计算。
根据分析,反应的NaOH的物质的量是:20×10-3L×0.2mol/L=4×10-3mol。
(1)如果生成的是Na2CO3:
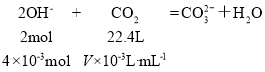
V=44.8mL
如果生成的是NaHCO3:
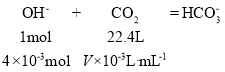
V=89.6mL
答案为:44.8;89.6;2OH-+CO2=CO32-↓+H2O(和44.8对应);OH-+CO2=HCO3-(和89.6对应)
(2)Na2CO3和NaHCO3都能和盐酸反应生成NaCl,所以,将上述白色固体加水溶解,加盐酸至pH=7再蒸干得白色固体均为NaCl,利用Na元素守恒有:
m(NaCl)=n(NaOH)=4×10-3mol×58.5gmol-1=0.234g。
答案为:0.234

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
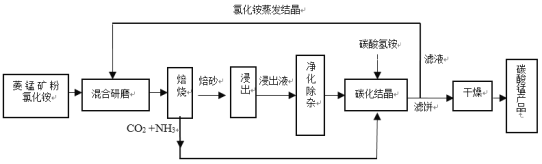
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
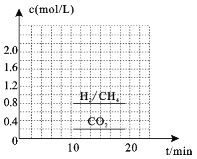
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
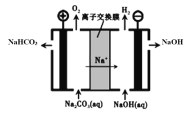
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。