题目内容
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:![]()
![]()
![]()
![]()
若某反应的平衡常数表达式为![]() ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2)![]() 在一定条件下可发生分解:
在一定条件下可发生分解:![]() ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量![]() 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a. ![]() 和
和![]() 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c. ![]() d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将![]() 和
和![]() 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成![]() ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下![]() 转化率随温度的变化关系。
转化率随温度的变化关系。
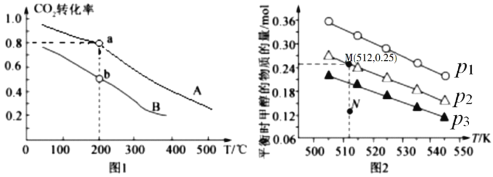
①a、b两点化学反应速率分别用![]() ,表示,则
,表示,则![]() _____
_____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol ![]() 和2.75 mol
和2.75 mol ![]() 发生反应:
发生反应:![]() CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为![]()
D.在![]() 及512 K时,图中N点
及512 K时,图中N点![]()
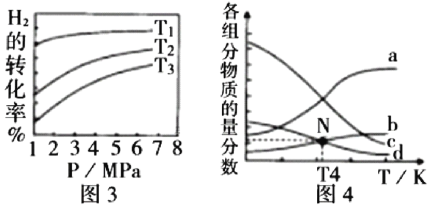
(5)![]() 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g) ![]() C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g) ![]() ;m代表起始时的投料比,即
;m代表起始时的投料比,即![]() 。
。
① 图3中投料比相同,温度![]() ,则该反应的焓变
,则该反应的焓变![]() _______0(填
_______0(填![]() )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
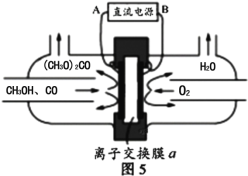
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________
【答案】![]() b 大于
b 大于 ![]() AC < CO2 阳膜
AC < CO2 阳膜 ![]()
【解析】
根据平衡常数的计算表达式书写化学方程式,利用盖斯定律计算反应的ΔH,根据判断条件是否为“变量”判断反应是否达到平衡,根据影响化学反应速率的因素比较化学反应速率大小,结合图像列三段式进行平衡常数的计算,根据电解池原理进行解答。
Ⅰ.(1)某反应的平衡常数表达式为![]() ,发生反应为
,发生反应为![]()
根据盖斯定律,②×2-③-①得出:![]() ;
;
(2)a.NO2和O2的浓度比始终都不变,不能确定反应是否达到化学平衡状态,a错误;
b.该反应为气体体积增大的反应,压强为变量,容器中压强不再变化,说明各组分的浓度不再变化,反应已达到化学平衡状态,b正确;
c.应为v正(NO2)=2v逆(N2O5)才表明达到化学平衡状态,c错误;
d.该反应前后都是气体,气体总质量、气体体积为定值,则密度为定值,不能根据密度判断平衡状态,d错误;
答案选b;
Ⅱ.(3)a、b两点温度相同,正反应为气体体积减小的反应,增大压强平衡正向移动,二氧化碳转化率增大,故压强曲线A大于曲线B,压强越大反应速率越快,故反应速率Va大于Vb;
(4)A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以P1<P2<P3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则

所以K=![]() =1.04×102;故C正确;
=1.04×102;故C正确;
D.由图可知,在p2及512K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),故D错误;
答案选AC;
(5)①由图3可知,相同压强下,温度越高氢气转化率越小,说明升高温度反应向逆向移动,正反应放热,△H<0;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,根据反应计量系数关系,曲线a代表的物质为H2,b表示CO2,c为H2O,d为C2H5OH;
(6)由图分析可知氧气得电子,发生还原反应,与氢离子结合生成水,该电极为阴极,则氢离子要透过交换膜a在阴极与氧气结合,则交换膜a为阳离子交换膜;阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e=(CH3O)2CO+2H+。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
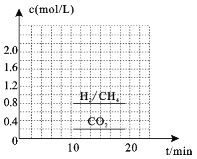
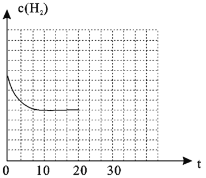
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
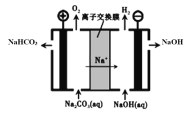
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过___________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡