题目内容
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量的关系如下图所示,符合图示情况的是

A.AB.BC.CD.D
【答案】C
【解析】
A.石灰水中通入二氧化碳,先发生反应Ca(OH)2+CO2=CaCO3↓+H2O,生成CaCO3沉淀,当Ca(OH)2溶液反应完后,再继续通入CO2发生反应CO2+CaCO3+H2O=Ca(HCO3)2,沉淀消失,所以前后两个过程消耗CO2的物质的量之比为1∶1,与图像不符,故A错误;
B.偏铝酸钠溶液中加入盐酸,先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+=Al3++3H2O,沉淀消失,所以前后两个过程消耗HCl的物质的量之比为1∶3,与图像不符,故B错误;
C.氯化铝溶液中加入氢氧化钠溶液中,先发生反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH=NaAlO2+2H2O,沉淀溶解,所以前后两个过程消耗氢氧化钠的物质的量之比为3∶1,与图像相符,故C正确;
D.氢氧化钠溶液中滴入氯化铝溶液,先发生反应Al3++4OH-=AlO2-↓+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应3AlO2-+Al3++6H2O=4Al(OH)3↓,生成沉淀至最大值并保持不变,与图像不符,故D错误;
故选C。

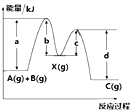
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
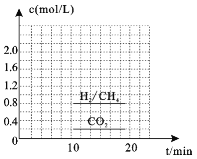
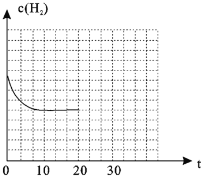
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
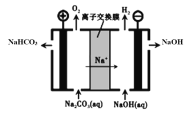
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。