题目内容
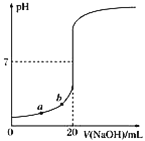
【题目】水的电离平衡曲线如图所示,下列说法正确的是
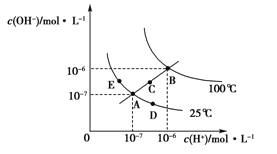
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
【答案】A
【解析】
A.在图中可看出:A、D、E是在25 ℃水的电离平衡曲线,三点的Kw相同。B是在100℃水的电离平衡曲线产生的离子浓度的关系,C在A、B的连线上,由于水是弱电解质,升高温度,促进水的电离,水的离子积常数增大,则图中五点KW间的关系:B>C>A=D=E,故A正确;
B.若从A点到D点,由于温度不变,溶液中c(H+)增大,c(OH-)减小。可采用在水中加入少量酸的方法,故B错误;
C.若从A点到C点,由于水的离子积常数增大,所以可采用升高温度的方法,故C错误;
D.若处在B点时,由于Kw=10—12。 pH=2的硫酸,c(H+)=10-2mol/L, pH=12的KOH, c(OH-)=1mol/L,若二者等体积混合,由于n(OH-)> n(H+),所以溶液显碱性,故D错误;
答案选A。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
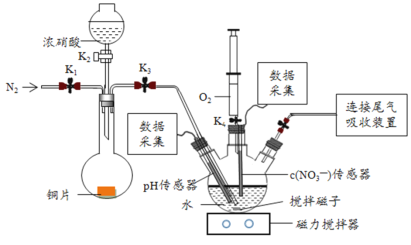
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
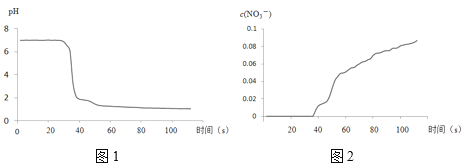
步骤II中,传感器记录数据如图所示:
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
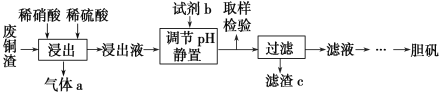
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
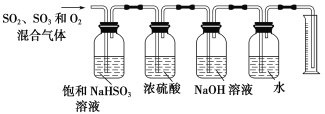
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。