题目内容
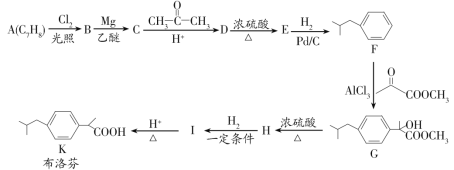
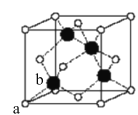
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ________________________________
(2)从开始至2min,Z的平均反应速率为 ________________
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ____________ 、 _______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 _________________ ,化学反应速率越大。

【答案】3X+Y2Z 0.05mol/(Lmin) 固体表面积 温度 温度越高
【解析】
(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=![]() 计算反应速率;
计算反应速率;
(3)探究影响化学反应速率的因素用到控制变量法。
(1)由图象可以看出,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X):△n(Y):△n(Z)=(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,则化学方程式为3X+Y2Z;
(2)反应开始至2min,气体Z的平均反应速率为v=![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(3)①由实验数据可知,Ⅱ、Ⅲ中接触面积不同,I、Ⅱ中温度不同,则该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
②Ⅰ和Ⅱ表明,温度高的反应时间少,则表明温度越高,反应速率越大。

 名校课堂系列答案
名校课堂系列答案【题目】已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(molL-1) | K1=5.6×10-2 K2=5.4×10-3 | K=1.7×10-5 | K=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)草酸(H2C2O4)是一种___(填“一元”、“二元”、“多元”)弱酸。25℃时,0.1molL-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是__。
(2)KHC2O4溶液呈酸性,向10mL0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液V(mL)。回答下列问题:
①当V<10mL时,反应的离子方程式为___。
②当V=10mL时,溶液中![]() 、
、![]() 、H2C2O4、H+的浓度由大到小的顺序为__。
、H2C2O4、H+的浓度由大到小的顺序为__。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(![]() )+c(
)+c(![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4);则a__b(填“<”“=”或“>”).
)+c(H2C2O4);则a__b(填“<”“=”或“>”).