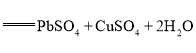题目内容
【题目】非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Ca2CO3, XO2(X= Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)基态硼原子的价电子排布图是____________,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为________________。
(2)B的简单氢化物BH3,不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
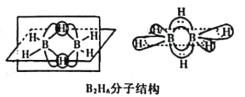
①B2H6分子结构如图,则B原子的杂化方式为____________________。
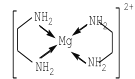
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______________,写出一种与氨硼烷互为等电子体的分子_________(填分子式)。
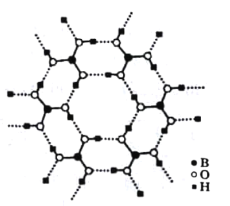
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为_______;硼酸在热水中比在冷水中溶解度显著增大的主要原因是____________。
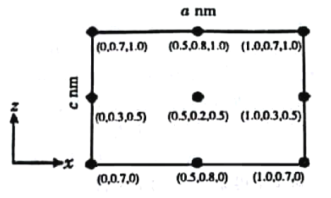
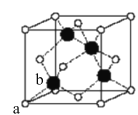
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。CsSiB3O7属于正交晶系(长方体形),晶胞参数为anm、bnm和cnm.如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为_________;CsSiB3O7的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则CsSiB3O7晶体的密度为_____g·cm-3(用含字母的代数式表示)。
【答案】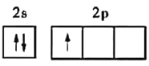 F>N>O>C>B sp3杂化 N C2H6 sp2 升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大 4
F>N>O>C>B sp3杂化 N C2H6 sp2 升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大 4 ![]()
【解析】
(1)B原子核外电子排布式为:1s22s22p1,基态硼原子的价电子排布图是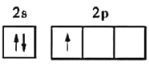 ,同周期第一电离能从左向右逐渐增大,N元素2P3为半充满结构,第一电离能变大,所以,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为F>N>O>C>B。故答案为:
,同周期第一电离能从左向右逐渐增大,N元素2P3为半充满结构,第一电离能变大,所以,与硼处于同周期的非金属主族元素的第一电离能由大到小的顺序为F>N>O>C>B。故答案为: ;F>N>O>C>B;
;F>N>O>C>B;
(2)①B2H6分子结构如图,B形成4个σ键,价层电子对为4,则B原子的杂化方式为sp3杂化。故答案为:sp3杂化;
②氨硼烷(NH3BH3)分子中存在配位键,提供孤电子对的成键原子是N,B提供空轨道,用价电子迁移法,N与B之间夹着碳元素,与氨硼烷互为等电子体的分子C2H6(填分子式)。故答案为:N;C2H6;
(3)H3BO3晶体为片层结构,B原子最外层有3个电子,与3个-OH形成3个共价键,B的杂化方式为sp2;硼酸在热水中比在冷水中溶解度显著增大的主要原因是:升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大。故答案为:sp2 ;升温破坏了硼酸晶体中的氢键,并且硼酸分子与水形成分子间氢键,使溶解度增大;
(4)原子分数坐标为(0.5,0.2,0.5)的Cs原子位于晶胞体内,原子分数坐标为(0,0.3,0.5)及(1.0,0.3,0.5)的Cs原子分别位于晶胞的左侧面、右侧面上,原子分数坐标为(0.5,0.8,1.0)及(0.5,0.8,0)的Cs原子分别位于晶胞的上底面、下底面,原子分数坐标为(0,0.7,1.0)及(1.0,0.7,1.0)(0,0.7,0)及(1.0,0.7,0)的Cs原子位于晶胞平行于y轴的棱上,则晶胞中Cs原子数目为:1+4×![]() +4×
+4×![]() =4,由化学式CsSiB3O7,可知晶胞相当于含有4个“CsSiB3O7”,故晶胞质量=4×
=4,由化学式CsSiB3O7,可知晶胞相当于含有4个“CsSiB3O7”,故晶胞质量=4×![]() g,则晶体密度=
g,则晶体密度=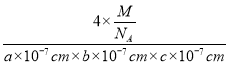 =
=![]() g·cm-3。故答案为:4;
g·cm-3。故答案为:4;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。