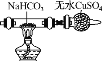题目内容
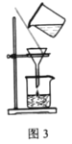
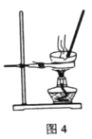
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
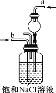
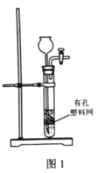
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 加热NH4Cl分解生成氨气和氯化氢,二者在试管口遇冷又结合为氯化铵,不能用于制备氨气,A错误;
B. 氨的溶解度大,干燥管装置可防止倒吸,氨气的溶解度远大于二氧化碳,为增大二氧化碳的溶解量,从a口通入足量氨气,再从b口通入足量二氧化碳可增大产品的产率,B正确;
C. 固液分离采用过滤法,分离出碳酸氢钠应采用过滤的方法,而不能用分液的方法,C错误;
D.碳酸氢钠只要分解就会产生水,无水CuSO4遇水就变蓝,无水CuSO4只能用来检验碳酸氢钠是否分解,不能用于检验是否完全分解,D错误;
故答案为:B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。