题目内容
17.下列实验现象的描述错误的是( )| A. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 | |
| C. | 氢气在氯气中安静燃烧,生成白烟 | |
| D. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
分析 A.红热的铁丝在氧气中燃烧,火星四射产生热量,生成黑色物质四氧化三铁;
B.钠元素的焰色反应为黄色,在空气中燃烧生成过氧化钠;
C.根据氢气在氯气中燃烧的现象来回答判断;
D.依据硫在氧气中燃烧现象解答.
解答 解:A.红热的铁丝在氧气中燃烧,火星四射产生热量,生成黑色物质四氧化三铁,故A正确;
B.钠元素的焰色反应为黄色,所以钠单质的焰色反应为黄色,燃烧生成淡黄色的过氧化钠,故B正确;
C.氢气在氯气中燃烧的现象:发出苍白色火焰,瓶口出现白雾,故C错误;
D.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰,故D正确;
故选:C.
点评 本题考查了物质燃烧的现象,熟悉物质的性质是解题关键,注意钠的焰色为黄色,注意化学中的烟是指固体颗粒,雾是指液滴,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
8.榴石矿石可以看作CaO、Fe2O3、A12O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如图1:
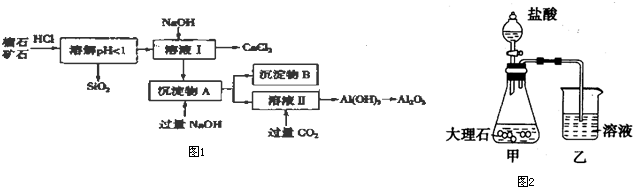
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是Fe3+、Al3+.
(2)对溶液进行操作时,控制溶液pH=9~10(有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致Al(OH)3溶解,Ca(OH)2沉淀.
(3)①某同学在实验室中用图2甲装置制取CO2气体并通入溶液图2乙中,结果没有沉淀产生,可能的原因是盐酸挥发,制取的二氧化碳中含有盐酸;为了能产生沉淀该同学对图甲装置进行了改进,改进的方法为在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶.
②若将二氧化碳气体通人澄清石灰水中,石灰 水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示CaCO3(s)?Ca2+(aq)+CO32-(aq).

(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是Fe3+、Al3+.
(2)对溶液进行操作时,控制溶液pH=9~10(有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致Al(OH)3溶解,Ca(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
②若将二氧化碳气体通人澄清石灰水中,石灰 水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示CaCO3(s)?Ca2+(aq)+CO32-(aq).
12.下列各组物质中,组内各种物质不都属于有机物的是( )
| A. | CH4、C2H6O、CH3Cl | B. | C100H202、C6H6、C2H2 | ||
| C. | H2O2、CH4、C2H6 | D. | C2H4、CH4、C6H5NO2 |
9.有四个电子层的某一元素原子中未成对电子数最多可达( )
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
6.下列反应中,不属于氧化还原反应是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸反应 | ||
| C. | 灼热的炭与CO2反应 | D. | CO与O2燃烧反应 |
7.下列各组混合物中,不能互溶的是( )
| A. | 乙醇和碘水 | B. | 乙醇和乙酸 | C. | 甲醛和水 | D. | 苯和水 |
 甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.
甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.