题目内容
2.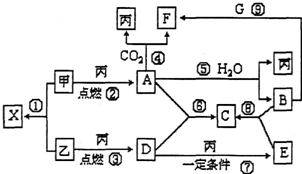 甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.
甲、乙、丙为常见单质,X、A、B、C、D、E、F、G均为常见的化合物,其中A为淡黄色固体,其摩尔质量和X相同,A、F、C、G的焰色反应都为黄色.在一定条件下,各物质间相互转化关系如图所示.请回答下列问题:
(1)用化学式表示:丙为O2,E为SO3
(2)反应③的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
(3)甲与H2O反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑.
(4)反应⑨的离子方程式为HCO3-+OH-=CO32-+H2O.
分析 甲、乙、丙为常见单质,A、F、C、G的焰色反应都为黄色,结合转化关系和反应条件可知丙为O2,A为淡黄色固体,则A为Na2O2,甲和丙反应生成的A则证明甲为金属钠Na,F为Na2CO3;A与水反应生成B为NaOH,则G为NaHCO3;A和X的摩尔质量相同为78g/mol,根据甲乙反应生成X可判断乙为S,所以X为Na2S;依据转化关系可知D为SO2,E为SO3;E与B反应生成C为Na2SO4,依据判断出的物质进行分析回答问题.
解答 解:甲、乙、丙为常见单质,A、F、C、G的焰色反应都为黄色,结合转化关系和反应条件可知丙为O2,A为淡黄色固体,则A为Na2O2,甲和丙反应生成的A则证明甲为金属钠Na,F为Na2CO3;A与水反应生成B为NaOH,则G为NaHCO3;A和X的摩尔质量相同为78g/mol,根据甲乙反应生成X可判断乙为S,所以X为Na2S;依据转化关系可知D为SO2,E为SO3;E与B反应生成C为Na2SO4,
(1)由上述分析可知,丙为O2,E为SO3,
故答案为:O2;SO3;
(2)反应③的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(3)甲与H2O反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(4)反应⑨的离子方程式为HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O.
点评 本题考查无机物的推断,为高频考点,侧重钠及其化合物、硫及其化合物性质及相互转化的考查,把握焰色反应推出甲为Na、A为Na2O2为解答的突破口,综合性强,题目难度较大.

| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |

①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应Ⅱ的离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol•L-1.则需调整pH=3时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾.
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2强(填“强”或“弱”).
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3:1.
| A. | 中和滴定实验中,盛装待测液的锥形瓶没有润洗,对实验结果无影响 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏低 | |
| C. | 用润湿的pH试纸测某溶液的pH,测定结果不一定有误差 | |
| D. | 测定中和热的实验中,将碱液缓慢倒入酸溶液中,所测中和热值偏低 |
| A. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 | |
| C. | 氢气在氯气中安静燃烧,生成白烟 | |
| D. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
| A. | CuS | B. | FeS | C. | NO2 | D. | FeCl2 |
| A. | 四氯化碳和水 | B. | 苯和汽油 | C. | 己烷与液溴 | D. | 溴丙烷和水 |
| A. | 电子层数逐渐增多 | B. | 原子半径逐渐增大 | ||
| C. | 最高正化合价数值逐渐增多 | D. | 金属性逐渐增强 |