题目内容
8.榴石矿石可以看作CaO、Fe2O3、A12O3、SiO2组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如图1:
(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是Fe3+、Al3+.
(2)对溶液进行操作时,控制溶液pH=9~10(有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致Al(OH)3溶解,Ca(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
②若将二氧化碳气体通人澄清石灰水中,石灰 水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示CaCO3(s)?Ca2+(aq)+CO32-(aq).
分析 CaO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,此时溶液中除了Ca2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Ca2+,加NaOH,Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,除去Fe3+、Al3+,加NaOH需将溶液的pH控制在9~10,否则氢氧化钙沉淀,过滤得沉淀氢氧化铝和氢氧化铁的混合物,然后向混合体系中加入过量的氢氧化钠,氢氧化铝溶解得到偏铝酸盐,向滤液中通入过量的二氧化碳气体得氢氧化铝沉淀,然后灼烧得到氧化铝;
(1)榴石矿可以看做CaO、Fe2O3、Al2O3、SiO2组成,榴石矿加盐酸溶解后,CaO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)当NaOH过量时,溶液碱性增强,Al(OH)3会溶解,从氢氧化物沉淀的pH表中可看出,Ca(OH)2在pH为12时开始沉淀,所以碱性增强Ca(OH)2会沉淀;
(3)①浓盐酸易挥发出氯化氢气体溶于水得到稀盐酸,可以和难溶于水的碳酸钙反应生成易溶于水的氯化钙;在实验装置甲和装置乙之间增加除去CO2中含有HCl气体的装置,根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
②根据沉淀溶解平衡的书写方法写出,注意固体稀溶液的标注方法.
解答 解:(1)榴石矿加盐酸溶解,CaO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,故答案为:Fe3+、Al3+;
(2)由(1)知,此时溶液中除了Ca2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Ca2+,加NaOH,Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,除去Fe3+、Al3+,加NaOH需将溶液的pH控制在9~10,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Ca(OH)2在pH为12时开始沉淀,所以碱性增强Ca(OH)2会沉淀,同时Ca2+也因转化为沉淀而损失,
故答案为:Al(OH)3;Ca(OH)2;
(3)①实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,反应的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,因盐酸易挥发出,盐酸是强酸,通入装置乙中的二氧化碳中含有盐酸,溶于水得到稀盐酸可以和难溶于水的碳酸钙反应生成易溶于水的氯化钙,所以没有沉淀产生,在实验装置甲和装置乙之间增加除去CO2中含有HCl气体的装置,NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,
故答案为:盐酸挥发,制取的二氧化碳中含有盐酸;在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶;
②将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,得到碳酸钙沉淀,碳酸钙的溶解平衡为CaCO3(s)?Ca2+(aq)+CO32-(aq),
故答案为:CaCO3(s)?Ca2+(aq)+CO32-(aq).
点评 本题主要考查了元素化合物中金属铝、铁、非金属碳的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | Al13与Al14互为同素异形体 | |
| B. | Al13超原子中Al原子间是通过离子键结合的 | |
| C. | Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定条件下能和镁作用生成Mg(Al13)2 |
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |

①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应Ⅱ的离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol•L-1.则需调整pH=3时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾.
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2强(填“强”或“弱”).
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3:1.
| A. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 | |
| C. | 氢气在氯气中安静燃烧,生成白烟 | |
| D. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 |

 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:

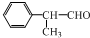 ,工业合成路线如下:
,工业合成路线如下: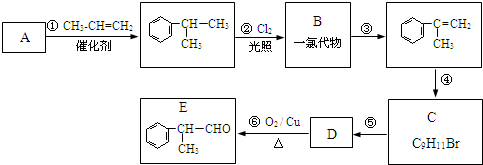
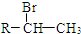
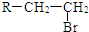 .(R-代表烃基)
.(R-代表烃基)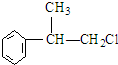 、
、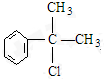 ;
;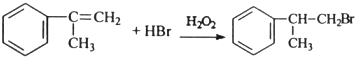 ;
;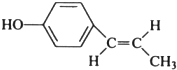 (只写反式结构).
(只写反式结构).