题目内容
7.下列各组混合物中,不能互溶的是( )| A. | 乙醇和碘水 | B. | 乙醇和乙酸 | C. | 甲醛和水 | D. | 苯和水 |
分析 根据相似相溶原理,极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,有机溶质极易溶于有机溶剂,氢键能增大物质的溶解性,据此分析解答.
解答 解:根据相似相溶原理,极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂,有机溶质极易溶于有机溶剂,氢键能增大物质的溶解性,
A.碘是非极性分子,乙醇为极性分子,但乙醇中分子极性较弱,碘易溶于乙醇,故A不选;
B.乙醇和乙酸都是有机物,所以乙醇易溶于乙酸,故B不选;
C.甲醛能和水形成氢键而导致甲醛极易溶于水,故C不选;
D.苯是有机物、水是无机物,且苯是非极性分子、水是极性分子,所以苯不易溶于水,二者混合分层,故D选;
故选D.
点评 本题考查相似相溶原理,明确相似相溶原理内涵是解本题关键,知道常见物质的分子极性,知道氢键对物质溶解度的影响,题目难度不大.

练习册系列答案
相关题目
17.下列实验现象的描述错误的是( )
| A. | 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 | |
| C. | 氢气在氯气中安静燃烧,生成白烟 | |
| D. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 |
2.下列关于能源和作为能源的物质的叙述中错误的是( )
| A. | 化石能源物质内部蕴储着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 物质的化学能可以在不同条件下转为热能、电能为人类所利用 | |
| D. | 我国经济发展要全部依靠化石能源 |
12.原子序数从11依次增加到17,下列叙述中,正确的是( )
| A. | 电子层数逐渐增多 | B. | 原子半径逐渐增大 | ||
| C. | 最高正化合价数值逐渐增多 | D. | 金属性逐渐增强 |
19.二氧化硫是引起酸雨的一种物质.二氧化硫属于( )
| A. | 酸 | B. | 氧化物 | C. | 碱 | D. | 混合物 |
16. 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
实验操作和现象:
查阅资料:a.S2O32-有较强的还原性
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
 某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).
某小组用如图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验).实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
b.酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中饱和NaCl溶液的作用是除去Cl2中的HCl,防止对Cl2与Na2S2O3的反应产生干扰.
(3)C中生成黄色沉淀的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O.
(4)为检验C中是否有SO2生成,需进行的操作是把白雾通入Ba(NO3)2溶液中,若有白色沉淀,证明有SO2生成.
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是S2O32-+4Cl2+5H2O=8Cl-+2SO42-+10H+.
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是氯气与水反应也能生成Cl-,所以检验出溶液中有Cl-也不能证明是Cl2氧化了Na2S2O3.
17.某粒子用ZARn+表示,下列关于该粒子的叙述中,正确的是( )
| A. | 所含的质子数=A-n | B. | 所含电子数=Z+n | ||
| C. | 所含的中子数=A-Z | D. | 质量数=Z+A |
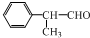 ,工业合成路线如下:
,工业合成路线如下: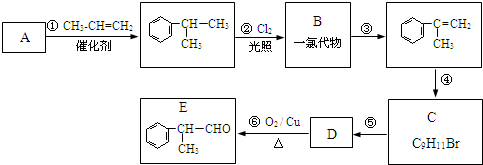
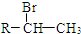
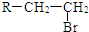 .(R-代表烃基)
.(R-代表烃基)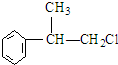 、
、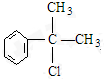 ;
;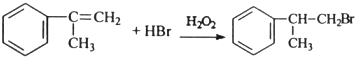 ;
;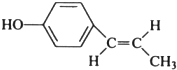 (只写反式结构).
(只写反式结构).