题目内容
15.已知NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 1mol铁与铝的混合物与足量稀硫酸反应时,转移电子数是3NA | |
| B. | 18g重水(D2O)含有的电子数为9NA | |
| C. | pH=2的醋酸加水稀释到10倍后,溶液中H+数目大于0.001NA | |
| D. | 标准状况下,NA个CH3OH分子的体积约是22.4L |
分析 A.1mol铁与稀盐酸反应生成亚铁离子失去2mol电子,1mol铝与稀盐酸反应生成铝离子失去3mol电子,二者失去的电子数不同,无法计算转移的电子数;
B.D2O中含有10个电子,摩尔质量是20g/mol;
C.溶液体积未知;
D.气体摩尔体积适用对象为气体.
解答 解:A.铁与盐酸反应生成的是亚铁离子,铝与盐酸反应生成的是铝离子,所以1mol铁铝混合物与足量盐酸反应失去的电子小于3mol,转移电子数小于3NA,故A错误;
B.18g重水(D2O)的物质的量是0.9mol,D2O分子中含有10个电子,含有的电子数为9NA,故B正确;
C.溶液体积未知,无法计算氢离子个数,故C错误;
D.标况下甲醇为液体,不能使用气体摩尔体积,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数,熟悉相关公式及气体摩尔体积适用对象和使用条件是解题关键,注意溶液必须告诉溶液的体积和浓度,才能计算溶质的物质的量,题目难度中等.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为
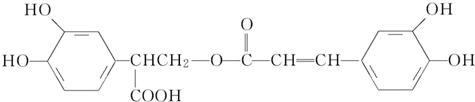 ,
,
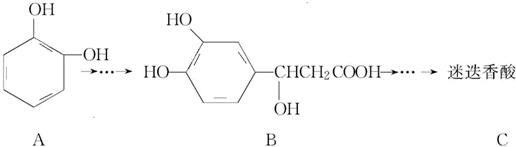
以邻苯二酚为原料合成迷迭香酸的路线为
下列说法正确的是( )
 ,
,以邻苯二酚为原料合成迷迭香酸的路线为

下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
6.Mg,Mg2+两种粒子中不相同的是( )
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | 酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| B. | 0.03mol/L NH4Al(SO4)2溶液与0.05mol/l Ba(OH)2溶液等体积混合:NH4++3Al3++5SO42-+5Ba2++10 OH-═5BaSO4↓+3Al(OH)3↓+NH3•H2O | |
| C. | 向烧碱溶液中加少量Ca(HCO3)2溶液:HCO3-+Ca2+OH-=CaCO3↓+2H2O | |
| D. | 在强碱溶液中次氯酸钠与氢氧化铁反应生成:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
20.下列叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 0.1 mol•L-1NH4A溶液显中性,说明HA为弱电解质 | |
| B. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| C. | Na、Al、Fe三种单质在一定条件下都能与水反应生成H2和相应的碱 | |
| D. | 水电离出的c(OH-)=1×10-13mol•L-1的溶液中,可能大量存在:Na+、K+、Cl-、HCO3- |
7.化学在生产和日常生活中有着重要的作用.下列说法正确的是( )
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| B. | “地沟油”不能食用,但经加工处理后,可用来制造肥皂和生物柴油 | |
| C. | 糖类、油脂、蛋白质等都具有固定的熔沸点 | |
| D. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油(如机油、润滑油等) |
4.能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+)=1×10-13mol•L-1时又一定能发生反应的离子组是( )
| A. | Fe2+、Na+、SCN-、Cl- | B. | Ca2+、Cu2+、NO3-、SO32- | ||
| C. | Na+、Ba2+、Cl-、HCO3- | D. | Al3+、Na+、SO42-、NO3- |
2.相同质量的下列物质分别与过量的金属钠作用时,放出氢气的质量最大的是( )
| A. | 甲醇 | B. | 乙醇 | C. | 乙二醇 | D. | 丙三醇 |