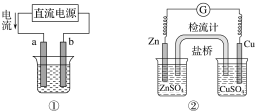
题目内容
【题目】已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系如图所示。下列说法不正确的是( )
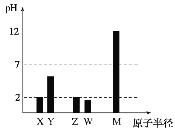
A. 从图中得出同浓度下W的最高价氧化物对应的水化物的pH比Z小,故非金属性:W>Z
B. X、Z的最简单气态氢化物在常温下可以反应生成离子化合物
C. X、Y、Z、W、M五种元素单质中Y常见单质熔点最高
D. 简单离子半径大小顺序:X>M
【答案】A
【解析】
X、Y、Z、W、M均为常见的短周期主族元素,由常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH,X的pH=2,为一元强酸,则为硝酸,X为N元素,Y的半径大于N,且酸性较硝酸弱,应为C元素;Z的原子半径大于C,Z的最高价含氧酸为一元强酸,则Z为Cl,W的原子半径大于Cl,且对应的酸的pH小于2,应为硫酸,W为S元素;M的原子半径最大,且0.01mol/LM的最高价氧化物对应的水化物溶液的pH为12,为一元强碱,则M为Na,据此分析解答。
根据上述分析,X为N元素,Y为C元素,Z为Cl元素,W为S元素,M为Na元素。
A.从图中得出同浓度下W的最高价氧化物对应的水化物的pH比Z小,Z的最高价含氧酸为一元强酸,则W的最高价含氧酸也是强酸,但是为二元强酸,不能据此说明非金属性强弱,实际上非金属性:W<Z,故A错误;
B.X为N元素,Z为Cl元素,X、Z的最简单气态氢化物分别为氨气和氯化氢,在常温下可以反应生成离子化合物氯化铵,故B正确;
C.C元素的单质常见的有石墨和金刚石,熔点均很高,而其他元素的单质是分子晶体或金属晶体,熔点均较低,故C正确;
D.X为N元素,M为Na元素,简单离子具有相同的电子层结构,核电荷数越大,离子半径越小,离子半径大小顺序:X>M,故D正确;
答案选A。