题目内容
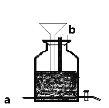
【题目】已知无水FeCl3能与氯苯反应:2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,实验室利用该装置制备无水FeCl2并检测FeCl3的转化率。已知:C6H5Cl、C6H4Cl2沸点依次为132℃、173℃。如图为制备FeCl2装置(加热和加持仪器省略)
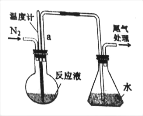
(1)蒸干并灼烧FeCl2溶液最终得到_____
(2)导管a的作用是_____;反应前通入N2的作用是_____;
(3)锥形瓶的作用是_____;该装置的不足之处为_____。
(4)反应结束后,回收过量氯苯的操作方法名称是_____。
若32.500g无水FeCl3与过量氯苯充分反应后将锥形瓶内溶液配制成250mL溶液,量取其中25.00mL溶液,滴加指示剂后,用0.4000mol/L的NaOH溶液滴定,重复三次,达到滴定终点平均消耗19.60mLNaOH溶液。
(5)滴定终点的现象是_____。
(6)FeCl3的转化率(转化量占总量的百分率)为_____%。
若制备反应后未通入足量N2,测定结果会_____(选项:偏高、偏低或不影响)
【答案】Fe2O3 导气,冷凝回流 除尽 O2 吸收HCl气体 无防倒吸装置 蒸馏 滴入最后一滴 NaOH,溶液恰好变成红色,且半分钟内不褪色 78.4% 偏低
【解析】
(1) FeCl2易被氧化为FeCl3,加热蒸干促进FeCl3水解;
(2) 2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑反应生成HCl气体,反应物C6H5Cl沸点较低;FeCl2具有还原性,易被氧气氧化;
(3)锥形瓶内的水吸收导管a排出的HCl气体;HCl易溶于水,引起倒吸;
(4)根据氯苯的沸点较低分析回收过量氯苯的方法;
(5)锥形瓶内的溶液为盐酸,滴入氢氧化钠,溶液pH逐渐增大;
(6)根据关系式2FeCl3~~~HCl~~~NaOH,计算FeCl3的转化率;若制备反应后未通入足量N2,则烧瓶内的HCl不能完全溶于锥形瓶内的水中。
(1) FeCl2被氧化为FeCl3,加热蒸干FeCl3水解为Fe(OH) 3灼烧分解为Fe2O3;
(2) 2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑反应生成HCl气体,反应物C6H5Cl沸点较低,所以导管a的作用是导出HCl气体、冷凝回流C6H5Cl;FeCl2具有还原性,易被氧气氧化,反应前通入N2,除尽装置中的O2;
(3)锥形瓶内的水吸收导管a排出的HCl气体,锥形瓶的作用是吸收HCl气体;HCl易溶于水,引起倒吸,该装置的不足之处为无防倒吸装置;
(4)氯苯的沸点较低,用蒸馏的方法回收过量氯苯;
(5)锥形瓶内的溶液为盐酸,用酚酞作指示剂,滴入氢氧化钠,溶液pH逐渐增大,滴定终点的现象是滴入最后一滴 NaOH,溶液恰好变成红色,且半分钟内不褪色;
(6)根据关系式2FeCl3~~~HCl~~~NaOH,参加反应的反应FeCl3的物质的量是![]() ,32.500g无水FeCl3的物质的量是0.2mol,FeCl3的转化率是
,32.500g无水FeCl3的物质的量是0.2mol,FeCl3的转化率是![]() 78.4%;
78.4%;
若制备反应后未通入足量N2,则反应生成的HCl不能完全溶于锥形瓶内的水中,所以测定结果会偏低。

【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
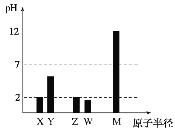
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
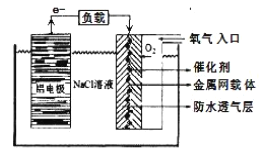
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
【题目】下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
元素 | 相关信息 |
A | 单质为密度最小的气体 |
B | 元素最高正价与最低负价之和为0 |
D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
E | 存在质量数为23,中子数为12的核素 |
F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基态原子的电子排布式_______________________。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途:_______________,
书写化合物甲与BD2的反应式并标出电子转移情况:_______________。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是______________。化合物乙的危害_______________________。(写一种)