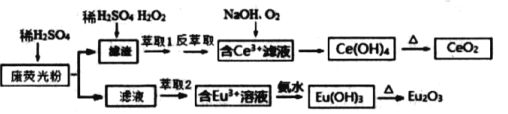
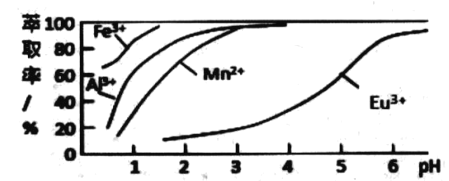
题目内容
【题目】达喜是常用的中和胃酸的药物,其有效成分是含结晶水的铝镁碱式盐。取该碱式盐6.02g,向其中逐滴加入4.00mol·L-1的盐酸,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时恰好反应完全。
(1)计算该碱式盐样品中碳酸根与氢氧根的物质的量之比:__。
(2)若达喜中镁、铝元素的物质的量之比为3:1,则氢元素的质量分数为__。
【答案】1:16 4.00%
【解析】
碱式碳酸盐与盐酸反应过程中先中和碱,再和碳酸盐生成碳酸氢盐,然后才会放出CO2气体,涉及到的化学反应有:①OH-+H+=H2O;②CO32-+H+═HCO3-;③HCO3-+H+═H2O+CO2↑;利用质量守恒,结合化学方程式计算。
(1)当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,所发生的反应分别为:①OH+H+=H2O;②CO32+H+═HCO3;③HCO3+H+═H2O+CO2↑;可得n(CO2)=n(CO32)=(45.0-42.5)×103L×4mol/L=0.01mol,而中和OH需要盐酸42.5mL2.5mL=40mL,所以n(OH)=40×103L×4mol/L=0.16mol,则n(CO32):n(OH) =1:16;
(2)镁、铝元素物质的量之比为3:1,令镁元素物质的量为3xmol,铝元素物质的量为xmol,根据化合价的代数和为0,则有6x+3x=0.16+0.01×2,解得x=0.02mol,结晶水的质量为(6.020.06×240.02×270.16×170.01×60)g=0.72g,n(H2O)=![]() =0.04mol,因此H元素质量分数为:
=0.04mol,因此H元素质量分数为:![]() ×100%≈4%。
×100%≈4%。

【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
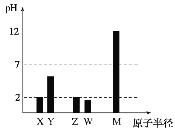
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
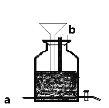
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。