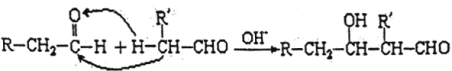
��Ŀ����
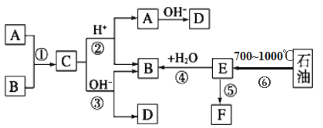
����Ŀ����֪��A��B��F�Ǽ�ͥ�г������л��A��B̼ԭ������ȣ�E��ʯ�ͻ�����չˮƽ�ı�־��F��һ�ֳ����ĸ߷��Ӳ��ϡ������Ǽ������ʵ�ת����ϵͼ��
���������գ�
��1������������Ϊ��_____________________________________��������Ӧ������ȡ����Ӧ����___________������ţ�
��2��д����B������̼ԭ�ӣ��Ҳ��ܷ�����ȼ����������Ӧ��ͬϵ��Ľṹ��ʽ��___��
��3��д����Ӧ�����õļ�ҺΪ����������Һ��д����Ӧ�۵Ļ�ѧ����ʽ____________��
��4��д��F������________________________����Ӧ�ݵķ�Ӧ����Ϊ_________��
��5��д������B�Ĵ���������Ļ�ѧ����ʽ____________��ʵ��������______��
��6��д���������ܷ���������Ӧ���ܷ���������Ӧ��C��ͬ���칹��ṹ��ʽ��
________________________��
���𰸡��ѽ� �٢ڢ� 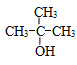 CH3COOCH2CH3+NaOH
CH3COOCH2CH3+NaOH![]() CHCOONa+CH3CH2OH ����ϩ �Ӿ۷�Ӧ CH3CHO+2Cu(OH)2+NaOH
CHCOONa+CH3CH2OH ����ϩ �Ӿ۷�Ӧ CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O��+3H2O ��ש��ɫ�������� CH2OHCH2CH2CHO ��CH3CHOHCH2CHO
CH3COONa+Cu2O��+3H2O ��ש��ɫ�������� CH2OHCH2CH2CHO ��CH3CHOHCH2CHO
��������
E��ʯ�ͻ�����չˮƽ�ı�־����EΪ��ϩ����ϩ��ˮ�ӳɵõ��Ҵ�����BΪ�Ҵ���A��B�������C����C�����Ի������ܷ���ˮ������A��B�� A��B̼ԭ��������Ҿ�Ϊ�����л����AΪ���ᣬCΪ����������DΪ�����ƣ� FΪ�߷��Ӳ��ϣ�FΪ����ϩ��
��1��ʯ���ڸ����²�����ϩ���壬�����ѽ⣬������Ӧ���Ҵ��������������Ӧ����ȡ����Ӧ������������ˮ������ȡ����Ӧ��������ȡ����Ӧ���Ǣ٢ڢۣ�
��2��BΪ�Ҵ���������̼ԭ�ӵ�ͬϵ��Ϊ���������ܷ�����ȼ����������Ӧ˵���ǻ�������̼ԭ����û����ԭ�ӣ��ṹ��ʽΪ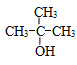 ��
��
��3����Ӧ�����õļ�ҺΪ����������Һ����������ˮ�⣬��ѧ����ʽCH3COOCH2CH3+NaOH![]() CH3COONa+CH3CH2OH��
CH3COONa+CH3CH2OH��
��4��F������Ϊ����ϩ����Ӧ�ݵķ�Ӧ����Ϊ�Ӿ۷�Ӧ��
��5��B�Ĵ���������Ϊ��ȩ�����鷽������������������ͭ��Ӧ����ѧ����ʽCH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O��+3H2O��ʵ����������ש��ɫ����������
CH3COONa+Cu2O��+3H2O��ʵ����������ש��ɫ����������
��6���ܷ���������Ӧ˵����ȩ�����ܷ���������Ӧ˵�����Ȼ����ǻ���C��ͬ���칹��ṹ��ʽCH2OHCH2CH2CHO ��CH3CHOHCH2CHO��

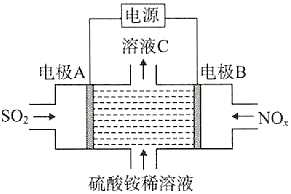
����Ŀ��FeSO4��Һ�����ڿ��������ױ��ʣ����Ϊ�˷���ʹ��Fe2+��ʵ�����г�������������茶���[�׳ơ�Ħ���Ρ�����ѧʽΪ(NH4)2Fe(SO4)26H2O]�������̷����̷���Һ���ȶ���
I��ij��ȤС�����ʵ���Ʊ���������茶��塣
��ʵ���У�������Һ�Լ�����ʹ�õ�������ˮ��������С���ȴ����ʹ�á���FeSO4��Һ�м��뱥��(NH4)2SO4��Һ����������_______����ȴ�ᾧ�����ˡ�ϴ�Ӻ����õ�һ��dz����ɫ�ľ��塣
II��ʵ��̽��Ӱ����Һ��Fe2+�ȶ��Ե�����
(1)����0.8 mol/L��FeSO4��Һ��pH=4.5����0.8 mol/L��(NH4)2Fe(SO4)2��Һ��pH=4.0������ȡ2 mL������Һ����֧�Թ��У��տ�ʼ������Һ����dz��ɫ���ֱ�ͬʱ�μ�2��0.01mol/L��KSCN��Һ��15min��۲�ɼ���(NH4)2Fe(SO4)2��Һ��ȻΪdz��ɫ��������Һ��FeSO4��Һ����ֵ���ɫ���ǡ�
������1��
���� | Fe(OH)2 | Fe(OH)3 |
��ʼ���� pH | 7.6 | 2.7 |
��ȫ���� pH | 9.6 | 3.7 |
���������ӷ���ʽ����FeSO4��Һ��������ɫ���ǵ�ԭ��___________________��
������Ӱ��Fe2+�ȶ��Ե����أ�С��ͬѧ�������3�ּ��裺
����1������������ͬʱ��NH4+�Ĵ���ʹ(NH4)2Fe(SO4)2��Һ��Fe2+�ȶ��ԽϺá�
����2������������ͬʱ����һ�� pH��Χ�ڣ���Һ pHԽСFe2+�ȶ���Խ�á�
����3��__________________________________________________��
(2)С��ͬѧ����ͼװ�ã�GΪ���������ƣ�������������������Һ�ֱ������ҺA��0.2 mol/L NaCl������ҺB��0.1mol/L FeSO4��Ϊ��ͬ�� pH���۲��¼�����ƶ������Լ���2����ʵ���о���ʵ�������±���ʾ��
��� | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | �����ƶ��� |
ʵ��1 | pH=1 | pH=5 | 8.4 |
ʵ��2 | pH=1 | pH=1 | 6.5 |
ʵ��3 | pH=6 | pH=5 | 7.8 |
ʵ��4 | pH=6 | pH=1 | 5.5 |
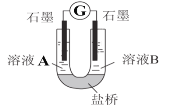
������2��ԭ���װ���У�����������ͬʱ��������Ӧ��Ļ�ԭ��Խǿ��������Ӧ���������Խǿ����ԭ��صĵ���Խ��
������3�������£�0.1mol/LpH=1��FeSO4��Һ��pH=5��FeSO4��Һ�ȶ��Ը��á�
��������ʵ������������Ϣ����С�����ۿ��Եó����½��ۣ�
��U������صĵ缫��Ӧʽ_________________��
�ڶԱ�ʵ��1��2����3��4������һ��pH��Χ�ڣ��ɵó��Ľ���Ϊ______ ��
�۶Ա�ʵ��_____��_____ ���ɵó���һ�� pH��Χ�ڣ���Һ����Ա仯�Ƕ�O2������ǿ����Ӱ�����ء�
�ܶԣ�����3��ʵ����ʵ�Ľ���Ϊ____________________��
����Ŀ����0.20 mol/L����������ʵ���Ũ��Ϊc mol/L��NaOH��Һ����ͬ��������Ƴ�������Һ���±�������ʱ��ȡ������ NaOH ��Һ������Ϻ���Һ��Na+��Cl-�����ʵ���Ũ�����ݣ�������Һ����仯����
��Һ | ���ǰ��ȡ��Һ�����mL�� | ��Ϻ�����Ũ�ȣ�mol/L�� | ||
HCl | NaOH | Na+ | Cl- | |
�� | 30 | x | 1.5z | z |
�� | 10 | y | z | 2z |
����˵����ȷ�� ��
A.x=90B.y=30C.z=0.10D.c=0.10