题目内容
【题目】铜、铁、铝是应用最广泛的三种金属。
(1)它们在人类的金属使用历史中,由早到晚的顺序为__________________________。
(2)日常常用“铝壶”烧开水,是因为铝有良好的导热性、__________________________。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出反应的化学方程式________________________________________________,该反应是_______ (填:吸或放)热反应,其中铝发生________(填:氧化或还原)反应。
(4)表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式_____________________________。
【答案】铜、铁、铝 铝表面有一层不和热水反应的致密氧化膜 2Al+Fe2O3![]() Al2O3+2Fe 放 氧化 4Al+3O2═2Al2O3
Al2O3+2Fe 放 氧化 4Al+3O2═2Al2O3
【解析】
(1)活动性弱的金属不易发生化学反应,能以单质形式存在,并比较容易冶炼,故人类使用金属的顺序正好和金属的活动性相反,所以,人类开始使用这三种金属的先后排序为:铜、铁、铝,故答案为:铜、铁、铝;
(2)铝极易与空气中的氧气发生反应生成一层致密的氧化铝薄膜,氧化铝与热水不反应,故答案为:铝表面有一层不和热水反应的致密氧化膜
(3)铝和氧化铁混合粉末反应得到液态铁,发生的是铝热反应,在引发剂作用下发生氧化还原反应,放出大量热,可以使生成的铁呈熔融状态,用来焊接钢轨,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe,铝在反应中发生氧化反应,作还原剂,故答案为:2Al+Fe2O3
Al2O3+2Fe,铝在反应中发生氧化反应,作还原剂,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;放;氧化
Al2O3+2Fe;放;氧化
(4)铝在常温下可以和氧气反应在其表面形成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2═2Al2O3,故答案为:4Al+3O2═2Al2O3。

【题目】下表是元素周期表的一部分。请按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ||||||||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
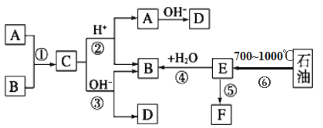
(1)表列①~⑨号元素中,原子半径最大的是________(填数字序号);非金属性最强的元素是________(填数字序号);最高价氧化物对应的水化物中酸性最强的是_______(填数字序号);化学性质最稳定的是________(填数字序号)。
(2)元素③的常见氢化物的电式为_________,此氢化物与元素⑨的氢化物化合后溶于水,水溶液中离子浓度由大到小的顺序是________(用离子符号表示)。
(3)将元素⑦的单质用砂纸打磨后,滴上几滴![]() 溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
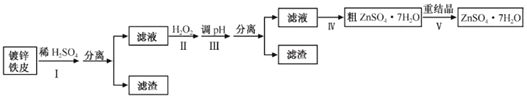
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
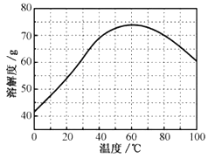
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
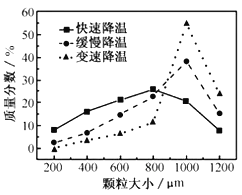
A.快速降温 B.缓慢降温 C.变速降温
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
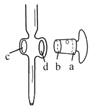
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
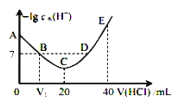
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图中滴定终点是的读数是___mL。