题目内容
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:“用水银一两,白矾[KAl(SO4)212H2O]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
①KAl(SO4)212H2O所属物质类别为___________ (填标号)。
A.硫酸盐 B.酸式盐 C.正盐 D.电解质
②文中“则粉升于盆上矣”涉及的分离方法是___________。
③甘汞(Hg2Cl2)制备反应中,还原剂与氧化剂的物质的量之比为_______,该反应中还原产物是_______。
④由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为_________。
(2)H2O2、酸性KMnO4在生产、生活、医疗卫生中常用作消毒剂,高锰酸钾造成的污渍可用草酸 (H2C2O4 )去除,完成下列问题。
①对于下列涉及H2O2的反应,H2O2仅体现氧化性的反应是_____(填标号,下同),H2O2既体现氧化性又体现还原性的反应是_______。
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
②酸性高锰酸钾与草酸反应,氧化产物与还原产物的物质的量之比为___________。
③在稀硫酸中,KMnO4和H2O2反应的离子方程式为_________。
【答案】ACD 升华 4:1 SO2 Hg2Cl2![]() Hg+HgCl2 C B 5:1 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
Hg+HgCl2 C B 5:1 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
【解析】
(1) ①KAl(SO4)212H2O在水中电离方程式为KAl(SO4)212H2O=K++Al3++2SO42-+12H2O,因而KAl(SO4)212H2O属于硫酸盐、正盐和电解质,故选ACD;
②“则粉升于盆上矣”说明固体变成了气体,涉及的分离方法是升华;
③由已知结合氧化还原反应原理,制取甘汞时,KAl(SO4)2作氧化剂,汞作还原剂,化学方程式表示为4KAl(SO4)2 + 6Hg + 6NaCl ![]() 3Hg2Cl2 + 3Na2SO4 + 2K2SO4 + 2Al2O3 + 3SO2↑,由化学方程式可得:若6molHg与8mol SO42-反应,生成3molSO2,则只有3mol SO42-被还原,故还原剂和氧化剂的物质的量之比为:
3Hg2Cl2 + 3Na2SO4 + 2K2SO4 + 2Al2O3 + 3SO2↑,由化学方程式可得:若6molHg与8mol SO42-反应,生成3molSO2,则只有3mol SO42-被还原,故还原剂和氧化剂的物质的量之比为:![]() ;氧化剂发生还原反应,生成还原产物,故该反应中还原产物是SO2;
;氧化剂发生还原反应,生成还原产物,故该反应中还原产物是SO2;
④甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),汞元素的化合价由+1升高为+2,因为Cl元素的化合价为最低价态,所以甘汞分解还会生成Hg,故化学方程式为:Hg2Cl2![]() Hg+HgCl2。
Hg+HgCl2。
(2) ①A.Ag2O+H2O2=2Ag+O2↑+H2O中Ag元素化合价由+1价变为0,O元素化合价由-1价变为0,结合元素化合价升降总数相等,O元素化合价不可能从-1降至-2,故H2O2为还原剂;
B.2H2O2=2H2O+O2↑中只有O元素化合价发生变化,O元素化合价由-1价升至0,同时O元素化合价由-1价降至-2,故H2O2为氧化剂和还原剂;
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中同时O元素化合价由-1价降至-2,故H2O2为氧化剂;
故H2O2仅体现氧化性的反应是C,H2O2既体现氧化性又体现还原性的反应是B;
②酸性高锰酸钾与草酸反应的方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,Mn元素化合价由+7变为+2,C元素化合价由+3变为+4,故氧化产物为CO2,还原产物为MnSO4,氧化产物与还原产物的物质的量之比为![]() ;
;
③在稀硫酸中,KMnO4和H2O2反应时,MnO4-作氧化剂,对应还原产物为Mn2+,H2O2作还原剂,对应氧化产物为O2,结合缺项配平的原理可知离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。

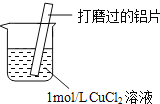
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .