题目内容
11.工业上以锂辉石(Li2O-Al2O3-4SiO2,含少量Ca.Mg元素)为原料生产碳酸锂,其部分工艺流程如下: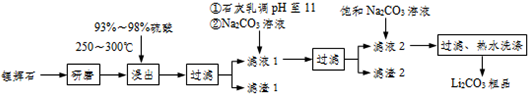
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
分析 锂辉石主要成分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素,研磨在加热条件下用浓硫酸酸浸后过滤得到Li2SO4,硫酸镁和硫酸钙,滤渣Ⅰ为Al2O3•4SiO2•H2O↓,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(1)依据过滤装置和操作步骤选择需要的玻璃仪器;
(2)滤渣I中分离制取Al2O3,加入过量酸溶解生成铝盐,加入过量一水合氨沉淀铝离子生成氢氧化铝沉淀,过滤得到滤渣3为氢氧化铝,灼烧得到氧化铝,步骤Ⅱ中反应是铝离子生成氢氧化铝的反应;
(3)滤渣Ⅰ为Al2O3•4SiO2•H2O,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(4)依据图表分析可知碳酸锂溶解度随温度升高减小;
(5)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂.
解答 解:锂辉石主要成分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素,研磨在加热条件下用浓硫酸酸浸后过滤得到Li2SO4,硫酸镁和硫酸钙,滤渣Ⅰ为Al2O3•4SiO2•H2O↓,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(1)过滤操作是在过滤器中进行,滤液流入烧杯,分离的溶液需沿玻璃棒慢慢注入,需要的玻璃仪器为漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)滤渣I中分离制取Al2O3,加入过量酸溶解生成铝盐,加入过量一水合氨沉淀铝离子生成氢氧化铝沉淀,过滤得到滤渣3为氢氧化铝,灼烧得到氧化铝,步骤Ⅱ中反应是铝离子生成氢氧化铝的反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:D;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)滤渣Ⅰ为Al2O3•4SiO2•H2O,滤液加入为石灰乳是氢氧化钙,向滤液Ⅰ中加入石灰水调pH为11的作用是提供氢氧根离子更完全的沉淀镁离子,加入碳酸钠沉淀钙离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
故答案为:让Mg2+生成Mg(OH)2沉淀;让Ca2+生成 CaCO3沉淀;Mg(OH)2和CaCO3;
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂的方程式为2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O,
故答案为:2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
点评 本题考查了物质生产流程的分析判断,流程分析,为高频考点,侧重于学生分析能力,有利于培养学生良好的科学素养,注意把握物质性质的应用,题目侧重铝及其化合物性质的应用,氧化铝的提取方法,题目难度中等.

| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
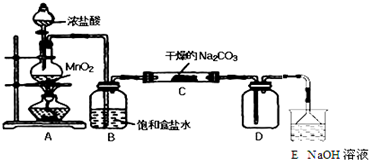
①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
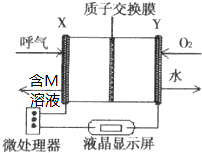 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
 命名该化合物时,应认定它的主链上的碳原子数目,正确的是( )
命名该化合物时,应认定它的主链上的碳原子数目,正确的是( )| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
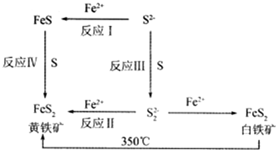 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.