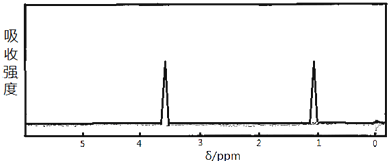
题目内容
20. Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
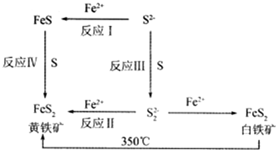
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.Ⅱ.锂一黄铁矿高容量电池,由于其污染小、成本低、电容量大、黄铁矿储备丰富而有望取代目前市场的碱性电池.制取高纯度黄铁矿的工艺流程如图:
(1)已知:Ksp(FeS=1.59×10-19,Ksp[Fe(OH)2]=4.87×10-17,为得到较纯的FeS沉淀,最好在FeCl2 溶液中加入的试剂为A(填序号)
A.(NH4)2S B.CuS C.H2S D.Na2S
(2)关于白铁矿与黄铁矿下列判断错误的是A(填序号)
A.属于同素异形体
B.因为晶体结构不同而导致性质有差别
C.黄铁矿比白铁矿更稳定
(3)反应Ⅲ制取 S22-时,溶液必须保持为碱性,除了S2- 与酸反应外,还有更重要的原因是(用离子方程式表示)S22-+2H+=S↓+H2S↑.
(4)室温下,Li/FeS2 二次电池所用的电解质是非水液体电解质,放电行为与温度有关.
①该电池电解质为非水液体电解质,原因是锂会和水反应产生自放电现象.
②温度低时,锂与FeS2反应只生成A物质,产生第一次放电行为;温度升高,锂与A继续反应(产物之一为Fe),产生第二次放电行为.若二次行为均进行完全且放电量恰好相等.请写出化学反应方程式:
第一次放电:2Li+FeS2=Li2FeS2;第二次放电:2Li+Li2FeS2=2Li2S+Fe.
(5)制取高纯度黄铁矿的另一种方法是:以LiCl-KC1低共熔点混合物为电解质,FeS为阳极,Al为阴极,在适当的电压下电解.写出阳极反应式2FeS-2e-=FeS2+Fe2+.
分析 Ⅰ.Li-Al/FeS电池是一种二次电池,原电池工作时,较为活泼的单质锂作负极,正负极反应相加可得反应的电池总反应;
Ⅱ.(1)根据Ksp的意义,越是Ksp小的物质越容易生成,注意不能引进杂质离子,据此回答;
(2)A.同素异形体是同种元素组成的单质;
B.黄铁矿和白铁矿的分子式是一样的性质有差别;
C.黄铁矿是白铁矿加热下的产物.
(3)S22-在酸性环境下可以发生自身氧化还原反应;
(4)①金属锂可以和水之间反应生成氢氧化锂和氢气;
②根据信息:第一次放电行为的反应是温度低时,锂与FeS2反应只生成A物质;第二次放电行为的反应是:温度升高,锂与A继续反应(产物之一为Fe),据此回答;
(5)FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应,据此书写电极反应.
解答 解:Ⅰ.该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe;负极的电极反应式为:Li-e-═Li+.正负极反应相加可得反应的电池总反应为2Li+FeS═Li2S+Fe,故答案为:2Li+FeS═Li2S+Fe;
Ⅱ.(1)越是Ksp小的物质越容易生成,CuS、H2S都和氯化亚铁之间不反应,硫化铵可以和氯化亚铁之间反应得到硫化亚铁沉淀,但是硫化钠的溶液碱性较强,不可避免的会产生氢氧化亚铁杂质,所以A更适宜.
故选A;
(2)A.同素异形体是同种元素组成的单质,但是黄铁矿和白铁矿是化合物,故A错误;
B.黄铁矿和白铁矿的分子式是一样的,因为晶体结构不同而导致性质有差别,故B正确;
C.黄铁矿是白铁矿加热下的产物,由此可见黄铁矿比白铁矿更稳定,故C正确;
故选A;
(3)S22-在酸性环境下可以发生自身氧化还原反应,即S22-+2H+=S↓+H2S↑,故答案为:S22-+2H+=S↓+H2S↑;
(4)①金属锂可以和水之间反应生成氢氧化锂和氢气;
②根据信息:第一次放电行为的反应是温度低时,锂与FeS2反应只生成A物质,即2Li+FeS2=Li2FeS2,第二次放电行为的反应是:温度升高,锂与A继续反应(产物之一为Fe),发生的反应为:2Li+Li2FeS2=2Li2S+Fe,故答案为:2Li+FeS2=Li2FeS2;2Li+Li2FeS2=2Li2S+Fe;
(5)FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应,发生的电极反应为:2FeS-2e-=FeS2+Fe2+,故答案为:2FeS-2e-=FeS2+Fe2+.
点评 本题综合考查学生元素以及化合物的性质、电化学反应原理等基本知识,属于综合知识的考查,难度中等.

①
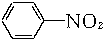 +3Fe+6HCl→
+3Fe+6HCl→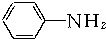 +3FeCl3+2H2O
+3FeCl3+2H2O②
 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$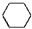
③2CH2═CH2+O2→2CH3CHO
④CH3CH2Cl+H2O$→_{△}^{NaOH}$ CH3CH2OH+HCl.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
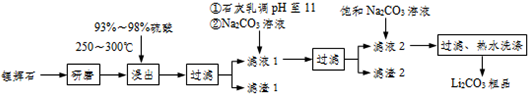
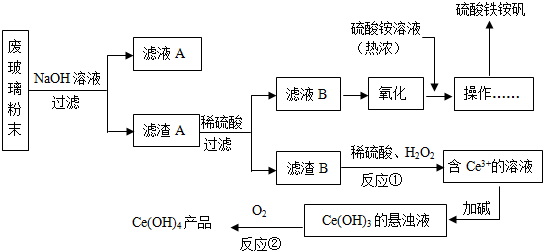
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
| A. | 服大量食盐水 | B. | 服鸡蛋清或牛奶 | C. | 服泻药 | D. | 服葡萄糖水 |
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 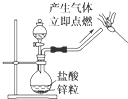 制备氢气并检验H2的可燃性 | |
| D. | 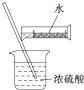 配制硫酸溶液 |
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+ 都被转化为Fe(OH)3(填名称)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+时所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
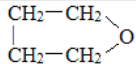 .
.