题目内容
3.常温下将氯化铵固体溶解在D2O(重水)中,下列有关水解的离子方程式或等式中正确的是( )| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
分析 氯化铵固体溶解在D2O(重水)中,发生水解,铵根离子结合OD-生成一水合氨,同时生成D+,以此来解答.
解答 解:氯化铵固体溶解在D2O(重水)中,发生水解,铵根离子结合OD-生成一水合氨,同时生成D+,
则水解离子反应为NH4++D2O?NH3•HDO+D+,
溶液中离子积为:c(OD-)•c(D+)=Kw,
故选B.
点评 本题考查水解的离子反应,明确水解的实质是解答本题的关键,注意铵根离子结合重水电离生成的OD-,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.某烃的一个分子中所含电子总数比原子个数多30个,既能发生取代反应,又能发生加成反应,此烃是下列中的( )
| A. | 1-丁烯 | B. | 二甲苯 | C. | 苯 | D. | 环己烷 |
14. 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如下表:
①某温度下,将2molCO(g)和6molH2(g)充入2L密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol/L,则CO(g)的转化率为50%,此时的温度为300℃.
②在恒容条件下,要提高CO(g)的转化率,可以采取的措施有DE(填字母序号).
A、升高温度 B、加入催化剂 C、增加CO(g)的浓度
D、充入H2(g)加压E、分离出甲醇 F、充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
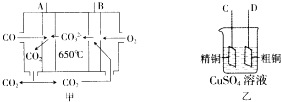
(3)如图甲是--碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请回答下列问题:
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要进行粗铜的精炼实验时,则B极应与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下) CO时,粗铜电极理论上减少铜的质量小于(填“大于”、“等于”或“小于”)6.4g.
 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.(1)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g);△H=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如下表:
| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,可以采取的措施有DE(填字母序号).
A、升高温度 B、加入催化剂 C、增加CO(g)的浓度
D、充入H2(g)加压E、分离出甲醇 F、充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图甲是--碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请回答下列问题:
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2.
②要进行粗铜的精炼实验时,则B极应与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下) CO时,粗铜电极理论上减少铜的质量小于(填“大于”、“等于”或“小于”)6.4g.
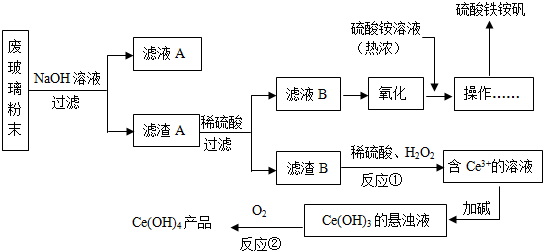
11.工业上以锂辉石(Li2O-Al2O3-4SiO2,含少量Ca.Mg元素)为原料生产碳酸锂,其部分工艺流程如下:
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
(1)过滤时需要的玻璃仪器有漏斗、玻璃棒、烧杯
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO2和Li2OCO4的溶解度如表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(2)滤渣I中分离制取Al2O3,其流程如下图所示(括号中均表示加入过量的试剂):括号内的试剂最好选用D
A.稀盐酸 B.CO2 C.NaOH溶液 D.NHyH2O
滤渣I$→_{I}^{(H+)}$滤液$→_{II}^{()}$滤渣3$→_{Ⅲ}^{灼烧}$Al2O3
步骤Ⅱ中反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)向滤液Ⅰ中加入石灰水调pH为11的作用是让Mg2+生成Mg(OH)2沉淀,加入Na2CO3溶液的作用是让Ca2+生成 CaCO3沉淀,滤渣2的成分是Mg(OH)2和CaCO3
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(5)工业上用电解法将Li2CO3粗品制成高纯LiOH,再向溶液中加入过量NH4HCO3溶液可生成高纯Li2CO3,写出加入NH4HCO3溶液后的反应的化学方程式2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
18.下列有机物的命名正确的是( )
| A. | 2,2-二甲基-1-丁烯 | B. | 2,3-二甲基-2-乙基丁烷 | ||
| C. | 3,3,5,5-四甲基己烷 | D. | 2-甲基-1,3-丁二烯 |
15.H2和O2的混合气体,在120℃和1.01×105Pa下体积为aL,点燃使其反应后恢复至原条件,其体积变为bL,则原混合气体中O2为( )
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
 .
.