题目内容
2.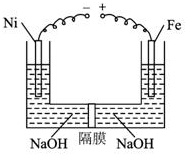 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
分析 铁与电源的正极相连,所以铁是阳极,电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O,Ni电极上氢离子放电,电极反应式为:2H2O+2e-═H2↑+2OH-,据此分析解答即可.
解答 解:A、铅蓄电池是二次电池,故A正确;
B、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe-6e-+8OH-═FeO42-+4H2O,故此电极附近氢氧根浓度减小,pH值降低,故B错误;
C、由分析可知,此电解池总反应为:Fe+2H2O+2OH-═FeO42-+3H2↑,故生成3mol氢气,生成高铁酸钠1mol,即当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4正确,故C正确;
D、铅蓄电池总反应为,铅做负极,二氧化铅做正极在硫酸中所以生成硫酸铅和水;Pb+PbO2+2H2SO4=PbSO4↓+2H2O,当阴极收集到0.15mol气体时,即转移电子数为0.3mol,铅蓄电池中消耗0.3molH2SO4正确,故D正确,故选B.
点评 本题考查了电解原理,正确判断阴阳极及发生的反应是解本题关键,易错选项是B,注意溶液酸碱性的变化,题目难度中等.

练习册系列答案
相关题目
12.已知反应O2(g)+2Cl2(g)?2Cl2O(g);△H>0.在三个恒温、恒容的密闭容器中分别充入1mol O2与2 mol Cl2,测得平衡时O2的转化率如下表:下列说法正确的是( )
| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
13.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如表:
(1)W位于元素周期表第四周期第IB族,W的基态原子核外电子排布式为:1s22s22p63s23p63d104s1.
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目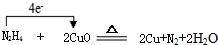 .
.
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目
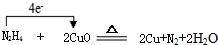 .
.
10.化学与生活、社会、材料密切相关.下列说法不正确的是( )
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
7.浓度均为0.1mol/L的五种溶液:①CH3COOH ②Ba(OH)2 ③CH3COONa ④NaOH ⑤Na2CO3中,由水电离出的c(H+)按由小到大的排列正确的是( )
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
14.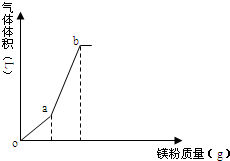 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |
11. 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
12.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  用图装置萃取溴水中的溴,并把溴的苯溶液从下口放出 | |
| B. |  用图装置可以验证溴乙烷发生了消去反应 | |
| C. |  用图装置配制银氨溶液 | |
| D. |  用图装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.