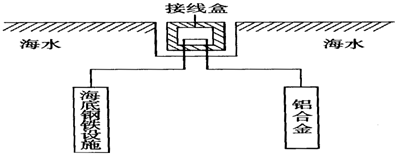
题目内容
13.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如表:| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目
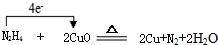 .
.
分析 X、Y、Z、W是元素周期表中原子序数依次增大的前四周期中常见的元素,X形成的单质是最清洁的能源,则X是H元素;Y的基态原子核外p能级总电子数比s能级总电子数少一个,核外电子排布为1s22s22p3,则Y为N元素;Z形成的多种单质,其中之一是地球生物的“保护伞”,则Z为O元素;W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属,则W为Cu,据此解答.
解答 解:X、Y、Z、W是元素周期表中原子序数依次增大的前四周期中常见的元素,X形成的单质是最清洁的能源,则X是H元素;Y的基态原子核外p能级总电子数比s能级总电子数少一个,核外电子排布为1s22s22p3,则Y为N元素;Z形成的多种单质,其中之一是地球生物的“保护伞”,则Z为O元素;W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属,则W为Cu.
(1)W为Cu元素,位于元素周期表第四周期第IB族,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:四、IB;1s22s22p63s23p63d104s1;
(2)由于N元素2p轨道为半充满状态,较稳定,则N的第一电离能大于O,NH3分子中存在3个N-H键,H2O的分子中存在2个O-H键,二者含有的σ键之比为 3:2,由于NH3与H2O分子之间形成氢键,氨气极易溶于水,
故答案为:大;NH3与H2O分子之间形成氢键;
(3)N2H4与CuO在加热条件下制得Cu单质,还生成H2O,出电子转移的方向与数目为: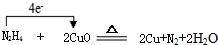 ,
,
故答案为: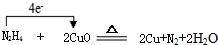 .
.
点评 本题考查结构位置性质关系应用,题目难度中等,注意理解同周期元素第一电离能异常情况,掌握单线桥、双线桥表示电子转移.

练习册系列答案
相关题目
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
1.由环已烷、乙醇、乙醚(C4H10O)组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数为( )
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
18.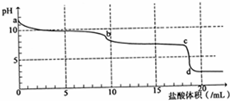 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
2.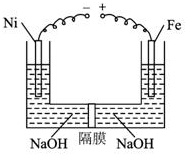 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
3.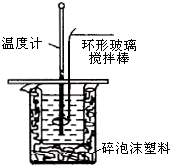 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
(5)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ,原因是浓硫酸溶于水放出热量.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
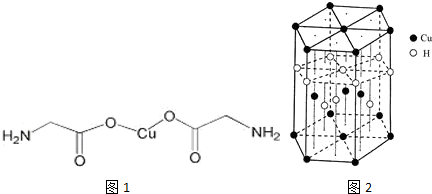
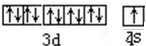 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.