题目内容
12.已知反应O2(g)+2Cl2(g)?2Cl2O(g);△H>0.在三个恒温、恒容的密闭容器中分别充入1mol O2与2 mol Cl2,测得平衡时O2的转化率如下表:下列说法正确的是( )| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
分析 A、根据温度高,压强大反应速率大判断;
B、根据②平衡时O2转化率比①大,说明平衡时②中气体的物质的量比①少;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,据此分析;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%.
解答 解:A、②平衡时O2转化率比①大,说明②相对于①平衡向正反应方向移动,所以开始时压强:p1<p2,则反应速率②>①,故A错误;
B、②平衡时O2转化率比①大,说明平衡时②中气体的物质的量比①少,又温度相同,则②中压强大所以平衡时压强:p1<p2,故B正确;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,即压强小于①,所以体积大于①,V1<V3,故C正确;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%,故D错误;
故选BC.
点评 本题考查外界条件对化学反应速率和平衡移动的影响,有一定的难度.

练习册系列答案
相关题目
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
17.下列现象说法正确的是( )
| A. | 红热的铁丝在氯气中燃烧产生棕色的烟雾 | |
| B. | 含有氯元素的物质都呈黄绿色 | |
| C. | 氢气在氯气中燃烧时火焰呈淡蓝色,在瓶口有白雾产生 | |
| D. | 钠在空气里加热,先熔成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体 |
1.由环已烷、乙醇、乙醚(C4H10O)组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数为( )
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
2.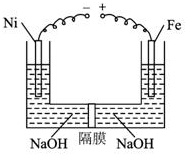 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
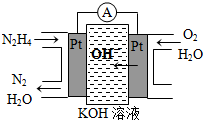 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题